
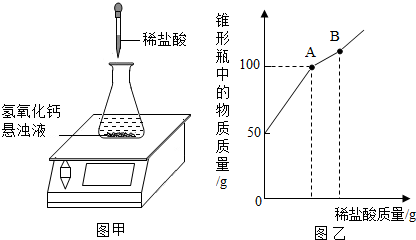
分析 氢氧化钙吸收空气中的二氧化碳生成碳酸钙而变质;向变质的氢氧化钙的浊液中滴加盐酸,盐酸先与氢氧化钙反应,生成氯化钙和水,而不能产生气体,因此,随盐酸的滴加瓶内质量不断增加,如图乙中的第一段曲线所示;当氢氧化钙完全反应后,继续滴加的盐酸开始与碳酸钙反应,即从图乙瓶内质量为100g时始,碳酸钙与盐酸反应生成氯化钙和水,同时放出气体二氧化碳,因此随盐酸的滴加瓶内物质质量增加情况如图乙中的第二段曲线;至碳酸钙完全反应后,滴加的盐酸不发生反应,瓶内质量增加情况如图乙中第三段曲线;根据与氢氧化钙阶段反应的化学方程式及消耗盐酸的质量,可计算出参加反应的氢氧化钙的质量,碳酸钙的质量为样品与氢氧化钙的质量差.
解答 解:(1)由题意和图象分析知,第一阶段锥形瓶中物质增加的质量就是与样品中氢氧化钙反应的盐酸的质量,第一阶段滴入盐酸的质量为100g-50g=50g
设与盐酸反应的Ca(OH)2的质量为x,生成氯化钙的质量为y.
Ca(OH)2+2HCl=CaCl2+2H2O
74 73 111
x 50g×14.6% y
$\frac{74}{x}$=$\frac{73}{50g×14.6%}$=$\frac{111}{y}$
x=7.4g y=11.1g
混合物中碳酸钙的质量为11.4g-7.4g=4g
答:此样品中氢氧化钙的质量是7.4g,碳酸钙的质量是4g;
(2)A点时所得溶液的溶质质量分数为$\frac{11.1g}{100g-4g}$×100%=11.6%.
答:(1)氢氧化钙有7.4g.碳酸钙有4g.(2)A点时所得溶液的溶质质量分数为11.6%.
点评 根据物质间反应的先后关系,分析反应对容器内物质质量的影响,得出所加入溶液的质量;然后根据反应的化学方程式,完成分析与计算.


科目:初中化学 来源: 题型:解答题
| 化学式 | 条件 | 1 mol气体体积/L |
| H2 | 0℃,101 kPa | 22.4 |
| O2 | 22.4 | |
| CO | 22.4 | |
| H2 | 0℃,202 kPa | 11.2 |
| CO2 | 11.2 | |
| N2 | 273℃,202 kPa | 22.4 |
| NH3 | 22.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | PM2.5主要是由于化石燃料的大量燃烧引起的,所以,为了降低空气中PM2.5的含量,我们应该马上停止使用化石燃料 | |
| B. | 鼻腔内的绒毛对空气中较粗的颗粒物具有一定的阻挡作用,这属于特异性免疫 | |
| C. | PM2.5主要是通过消化道进入人体内部的 | |
| D. | 减少PM2.5对保护环境,维持生态系统的稳定性将起到重要作用 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①③ | B. | ③⑥ | C. | ②④⑥ | D. | ①②④⑤⑦ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图是某硫酸试剂瓶标签上的部分文字说明.
如图是某硫酸试剂瓶标签上的部分文字说明.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | C2H6比CH4中的C原子个数多 | |
| B. | 根据C2H6和CH4可知,有机物中都不含氧元素 | |
| C. | 相同质量的C2H6和CH4完全燃烧消耗的氧气质量相同 | |
| D. | 两种气体点燃前都需要验纯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com