
如图装置所示,胶头滴管中盛有液体a,广口瓶内盛有固体b,如果将a滴加到b上后,气球会逐渐变瘪的是( )
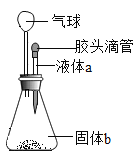
选项 | 液体a | 固体b |
A | 水 | 氢氧化钠 |
B | 过氧化氢溶液 | 二氧化锰 |
C | 水 | 硝酸铵 |
D | 水 | 氯化钠 |
A.A B.B C.C D.D
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:初中化学 来源:备战2020中考化学考题专项训练--燃烧与灭火 题型:单选题
某班同学利用如图所示的装置探究燃烧条件,已知白磷的着火点是40℃,红磷的着火点是240℃.该同学根据实验现象得到燃烧条件正确的是( )

A.铜片上的白磷燃烧,浸泡在热水中的白磷不燃烧.得到的燃烧条件是燃烧必须与氧气接触
B.铜片上的白磷能够燃烧,红磷不燃烧.得到的燃烧条件是燃烧必须有可燃物
C.热水中的白磷和铜片上的红磷都不燃烧,得到的燃烧条件是温度没有达到可燃物的着火点
D.如果给放在热水中的白磷通入氧气,白磷也会燃烧.说明白磷的着火点是80℃
查看答案和解析>>
科目:初中化学 来源:2020届初三《新题速递·化学》2月第01期(考点08-10) 题型:填空题
我国“海洋六号”科考船在深海的冷泉周围收集到可燃冰。可燃冰是资源量丰富的高效清洁能源,能释放出天然气。
(1)天然气燃烧的化学方程式为___________________________________________。
(2)工业上利用甲烷获得新能源氢气,反应的微观示意图如下:

①请在横线上补全相应微粒的图示___________。②生成物的质量比是__________。
查看答案和解析>>
科目:初中化学 来源:备战2020中考化学考题专项训练--专题十四:溶液 题型:填空题
A B C三种物质(不含结晶水)的溶解度曲线如图,请回答:

(1)P点表示的意义为______;
(2)t2℃时,将18gA物质加入50g水中,充分溶解,所得溶液的质量为______g;
(3)将t3℃时A、B、C三种物质的饱和溶液降温到t1℃,三种溶液中溶质质量分数由大到小的顺序是______;
(4)A中混有少量的B,要提纯得到A,应采用的结晶方法是______(填降温或蒸发溶剂)。
查看答案和解析>>
科目:初中化学 来源:备战2020中考化学考题专项训练--专题十四:溶液 题型:单选题
下列各因素不会影响固体溶解度的是( )
A.溶质的种类 B.溶剂的种类 C.溶剂的质量 D.温度的变化
查看答案和解析>>
科目:初中化学 来源:备战2020中考化学考题专项训练--专题四:金属与金属材料 题型:科学探究题
为了测定某样品中氧化铁(Fe2O3)的质量分数(杂质不含铁元素,且不溶于水和酸),化学兴趣小组的同学进行了如下的实验。
(查阅资料)
1.草酸(H2C2O4)在浓硫酸作用下受热分解,化学方程式为:
H2C2O4  CO2↑+CO↑+H2O
CO2↑+CO↑+H2O
2.碱石灰能吸收二氧化碳和水蒸气
(实验设计及操作)用下图所示装置进行实验:

(问题讨论)
(1)装药品前应先 ,实验中观察到E中现象是:固体颜色 ;
(2)进入E中的气体是纯净、干燥的CO,则B、C、D中依次是 (填序号)。
① 浓硫酸、石灰水、氢氧化钠溶液
② 石灰水、氢氧化钠溶液、浓硫酸
③ 氢氧化钠溶液、石灰水、浓硫酸
(3)G的作用是 ;E中反应的化学方程式是 ;
(4)当E中固体完全反应后, 处应先停止加热(填序号A或E);
(5)上述实验装置的一处明显缺陷是: 。
(数据处理)
称取样品8.0g,用上述装置进行实验,充分反应后称量F装置增重4.4g。则样品中氧
化铁质量分数为 。
(实验反思)
当观察到E中固体全部变黑后,若立即停止通CO,则测得的样品中氧化铁的质量分数
(填“偏大”,“偏小”,“无影响”)。
查看答案和解析>>
科目:初中化学 来源:备战2020中考化学考题专项训练--专题四:金属与金属材料 题型:综合题
金属在日常生活、工农业生产和科学研究方面应用广泛。
(1)某实验小组为了探究锌与硫酸反应快慢的影响因素,进行了如下实验。
实验编号 | 硫酸的质量分数 (均取20 mL) | 锌的形状 (均取1g) | 氢气的体积(mL) |
① | 20% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 30% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
①用如图装置收集并测量氢气的体积,其中量筒作用是_____________________,氢气应从_____(填e或f或g)管通入。
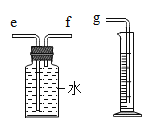
②要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是___________。
③下表是小兵第①组实验的详细数据。
时段 | 第1分钟 | 第2分钟 | 第3分钟 | 第4分钟 | 第5分钟 | 第6分钟 |
H2的体积 | 3.1mL | 16.7mL | 11.9mL | 9.6mL | 7.6mL | 6.0mL |
请描述锌与硫酸反应的快慢的变化_________________________________________。
解释原因_________________________________________________________。
(2)保险粉(化学式 Na2S2O4)在工农业生产中有广泛的用途,Na2S2O4 在碱性溶液中稳定,在中性和酸性溶液中极不稳定;在 NaCl 存在下,Na2S2O4 在水中溶解度显著下降。Na2S2O4 制备流程如下:
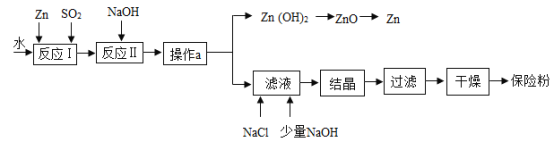
①已知反应Ⅰ的原理为:Zn + 2SO2 == ZnS2O4,反应Ⅱ为复分解反应,反应Ⅱ的化学方程式为______________________________________________。
②操作a的名称为_______________________。
③滤液中含有 Na2S2O4,为使 Na2S2O4 结晶析出还需要加入少量 NaOH 的原因是__________________________, 加入NaCl的原因是_______________________。
④198gZn(OH)2理论上能得到Zn的质量为_____________。
查看答案和解析>>
科目:初中化学 来源:备战2020中考化学考题专项训练--化学与生活 题型:填空题
人类的日常生活、工农业生产都与化学密不可分。请回答:
(1)农业上使用的硝酸钾属于_________肥。
(2)饮用硬度过大的水不利于健康,生活中常用_________方法来降低水的硬度。
(3)冰箱中放活性炭除去异味,这是利用了活性炭的________性。
(4)有机合成材料的出现是材料史上的一次重大突破。下列属于有机合成材料的是______。
A 不锈钢汤勺 B 塑料果盘 C 纯棉围巾 D 玻璃杯
查看答案和解析>>
科目:初中化学 来源:聚焦2020九年级化学基础演练--专题三十三 :中和反应 溶液的pH 题型:计算题
实验室中有一瓶标签被腐蚀的盐酸,小丽为了测定溶液中溶质的质量分数,在烧杯中配制了8克10%的氢氧化钠溶液,然后往烧杯中滴加该盐酸,反应过程中溶液的pH与滴入盐酸的质量关系如图所示。请回答下列问题:
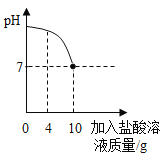
(1)配制8克10%的氢氧化钠溶液,需要水的质量为______g;
(2)计算该盐酸的溶质质量分数;__________(写出计算过程)
(3)当滴入4克盐酸时,烧杯内溶液中钠元素的质量为_______g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com