
【题目】铷元素在元素周期表中的信息与物原子结构示意图如下图所示,下列说法不正确的是
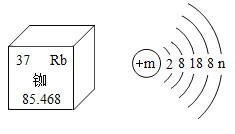
A.m=37
B.物原子的相对原子质量是85.468
C.氧化铷的化学式为RbO
D.如原子的质量主要由构成其原子核的质子和中子的质量决定
【答案】C
【解析】
在原子中,原子序数=核电荷数=质子数=核外电子数。
A、左上角的数字为37,表示原子序数为37;在原子中,原子序数=核电荷数=质子数=核外电子数,则该元素的原子的核内质子数和核外电子数为37,则m=37,故A正确;
B、汉字下面的数字表示相对原子质量,铷原子的相对原子质量是85.468,故B正确;
C、在原子中,质子数=核外电子数,![]() ,
,![]() ,铷原子的最外层电子数为1,在化学反应中易失去1个电子而形成带1个单位正电荷的阳离子,化合价的数值等于离子所带电荷的数值,则该元素的化合价为+1价,氧元素显-2价,组成化合物的化学式为Rb2O,故C不正确;
,铷原子的最外层电子数为1,在化学反应中易失去1个电子而形成带1个单位正电荷的阳离子,化合价的数值等于离子所带电荷的数值,则该元素的化合价为+1价,氧元素显-2价,组成化合物的化学式为Rb2O,故C不正确;
D、原子的质量主要集中在原子核上,铷原子的质量主要由构成其原子核的质子和中子的质量决定,故D正确。故选C。


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:初中化学 来源: 题型:
【题目】一定条件下,在一个密闭容器内有五种物质,充分反应后,测得反应前后各物质的质量如下:则下列推理不正确的是
物质 | A | O2 | CO2 | H2O | N2 |
反应前质量/g | 24.4 | 109.6 | 2.4 | 1.2 | 5.6 |
反应后质量/g | 0 | 100 | 20 | 12 | X |
A.物质A中碳元素和氢元素的质量比为4:1
B.物质A由碳、氢和氮三种元素组成
C.x=11.2
D.上述五种物质中有两种属于氧化物
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对比归纳是学习化学的重要方法。请你参与下图三个探究活动并回答问题。
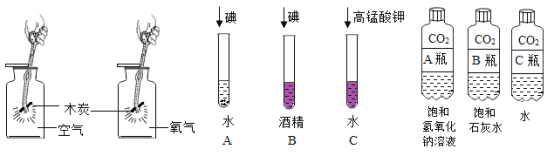
(探究活动一)探究影响木炭燃烧剧烈程度的因素:
木炭在氧气中燃烧比在空气中燃烧更剧烈,说明了影响木炭燃烧剧烈程度的因素是_____。
(探究活动二)探究影响物质溶解性的因素:
(1)同学们做了A试管和B试管的对比实验,发现B试管中固体可溶,A试管中固体几乎不溶。该对比实验说明了影响物质溶解性的因素是_____。
(2)同学们又补充了C试管所示实验,他们想探究的影响因素是_____。
(探究活动三)探究二氧化碳能否与水、饱和石灰水、氢氧化钠溶液反应:
小明分别振荡三个软质塑料瓶,观察到塑料瓶都变瘪且变瘪的程度由大到小的顺序为A>B>C。
(1)小明认为二氧化碳与三种物质都能发生反应,你认为小明的结论_____(填“是或否”)正确,理由是_____。
(2)B瓶中发生反应的化学方程式为_____。
(3)对比A瓶与_____瓶的实验现象,可证明二氧化碳能与氢氧化钠溶液发生反应且溶质的溶解性更强。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2018年10月24日,港珠澳大桥正式开通,让世人再次见证我国在基础设施建设方面的巨大成就。大桥建设过程使用了大量的石灰石资源。

(1)煅烧石灰石可制得CaO,为测定不同煅烧温度对CaO活性的影响,取石灰石样品分为三等份,在同一设备中分别于800℃、900℃和1000℃条件下煅烧,所得固体分别与等质量的水完全反应,测得反应液温度随时间的变化如图1所示。
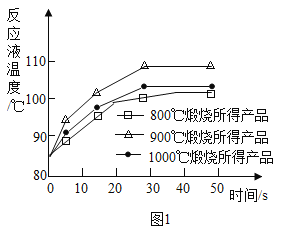
可知:CaO与H2O反应会热量_____(填“放出”或“吸收”);上述温度中,_____℃烧所得CaO活性最高。要得出正确结论,煅烧时还需控制的条件是_____。
(2)以电石渣[主要成分为Ca(OH)2,还含有少量MgO等杂质]为原料制备高纯CaCO3的流程如图2:
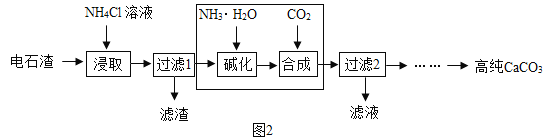
图3为NH4Cl浓度对钙、镁浸出率的影响
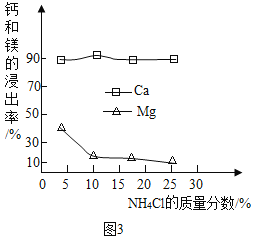
(浸出率=![]() ×100%)
×100%)
可知:①较适宜的NH4Cl溶液的质量分数为_____;浸取时主要反应的化学方程式为_____,反应类型属于_____。
②流程中线框内部分若改用_____溶液(填化学式),也可一步得到与原流程完全相同的生成物。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在密闭容器中,有甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量分数如图所示,下列说法错误的是
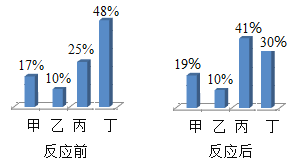
A.该反应是分解反应
B.生成的甲、丙两种物质的质量比为8:1
C.乙物质可能是该反应的催化剂
D.参加反应的丁物质的质量等于生成的甲物质和丙物质的质量之和
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】认识氨气:材料:①氨气是无色有强烈的刺激气味的气体:②密度比空气小;③降温至-33.5℃可变为液态;④1体积水大约溶解700体积氨气,其水溶液显碱性;⑤在高温条件下分解生成氮气和氢气;⑥与氯化氢气体混合产生白烟(成分为氯化铵);⑦用于制液氮、氮水、硝酸、铵盐和胺类等。⑧工业上用氮气和氢气在高温高压催化剂作用下合成氨气;⑨实验室可用加热氯化铵和熟石灰两种固体的方法制取氨气
(1)物质的组成与结构。写出氨气的化学式并标注氮元素的化合价__________,由其化学式可获得关于氨气定量组成的信息是___________(写一条)。
(2)物质的性质。阅读上文,归纳氨气的化学性质(至少两条)________________。
(3)物质的变化
I.用方程式表示工业和实验室制取氨气时发生的化学变化___________
II.变化③中不发生变化的是_____________(填字母编号)。
a.氨分子的能量;
b.氨分子的运动速率;
c.氨分子的质量;
d.氨分子之间的相互作用;
e.氨分子的化学性质;
f.氨分子之间的间隔;
g.氨分子的构成
从微观的角度看变化③和⑥的本质区别是__________。
III.描述变化⑤的微观过程_____________
(4)物质的制备
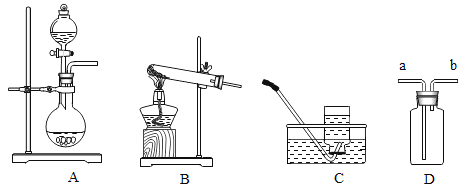
①工业制氨气所用催化剂可重复使用,其原因是_____________。
②实验室制取氨气应选取的发生装置______________(填装置编号)是检查该装置气密性的方法是___________________,用D装置收集氨气时,验满的方法是_______________,将湿润的_____________(填“红色”或“蓝色”)石蕊试纸。放在__________(填“a”或“b”)处,观察到_________________证明集满。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某石油化工厂化验室的实验员用15%的氢氧化钠溶液洗涤一定量石油产品中的残余硫酸,测得实验数据如表:
实验序号 | 消耗NaOH溶液的质量 | 洗涤后溶液的pH |
① | 30g | pH<7 |
② | 40g | pH=7 |
③ | 50g | pH>7 |
请回答下列问题:
(1)欲计算出一定量石油产品中所含H2SO4的质量,你觉得应该选择实验序号 的数据。
(2)若一定量石油产品中残余硫酸的质量为100g,请计算该残余硫酸的溶质质量分数(写出详细的计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学在实验室用石灰石(杂质不含钙元素,不溶于水也不与酸反应)和稀盐酸制取二氧化碳气体,回答下列问题:
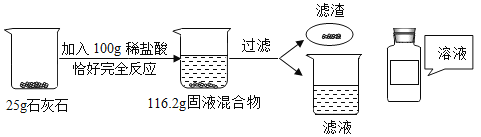
(1)石灰石与稀盐酸反应的化学方程式为_____。
(2)列出根据已知条件求解25g石灰石中参加反应的物质的质量(x)的比例式_____。
(3)配制100g上述稀盐酸,需质量分数36.5%的浓盐酸的质量为_____。
(4)向反应后的滤液中加入332.8g水,最终所得溶液溶质质量分数为_____,该溶液应装入_____保存,请在上图中填好标签_____。
(5)某工厂要用该石灰石制取生石灰,若要制得含杂质5%的生石灰112t,假设在煅烧的过程中有5%的原料损失,则需要上述石灰石的质量为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】图一是镓原子的有关信息图,图二是某反应的微观模拟图。请回答
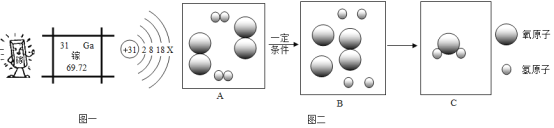
(1)镓是一种奇妙的金属,放在手心马上熔化,说明镓的_____________。
(2)在元素周期表中,镓元素排第________周期;3个镓离子可表示为_____________。
(3)请在图二C中将需要补充的相关粒子补画完整__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com