C
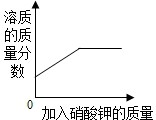
分析:A、根据饱和溶液的定义来进行解答;
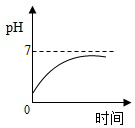
B、根据酸碱中和pH的变化分析;
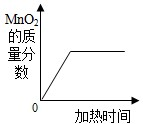
C、在氯酸钾分解的化学反应中,二氧化锰充当的是催化剂,根据催化剂的定义及质量分数的定义可以完成判断;
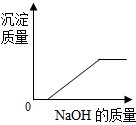
D、硫酸铜可以和氢氧化钠反应生成沉淀,但是在酸性环境中沉淀难以形成,可以据此解答;
解答:A、刚开始是不饱和硝酸钾溶液,溶质硝酸钾的质量大于0;当不断加入硝酸钾固体时,溶质的质量在不断增加,溶质的质量分数逐渐增大;当硝酸钾不再溶解时,溶液饱和,溶质不变,溶质的质量分数也恒定不变.图象能正确反映其对应操作;故A正确;
B、氢氧化镁与胃酸中的盐酸作用,是酸性减弱,pH变大,但由于氢氧化镁是难溶性的碱,故不会变成碱性,故B正确;
C、在氯酸钾分解的化学反应中,二氧化锰充当的是催化剂,根据催化剂的定义可以知道,在反应前后其质量是不变的,而氯酸钾分解还要产生氯化钾固体和氧气,根据质量分数的定义,混合物的质量逐渐减少,故二氧化锰的质量分数逐渐增加,但二氧化锰的质量分数起点不是0,故C错误;
D、硫酸铜溶液可以和氢氧化钠溶液反应生成氢氧化铜沉淀,但是氢氧化铜能够溶于稀盐酸,所以开始加入氢氧化钠时溶液中不会产生沉淀,直至把稀盐酸消耗完全后才会产生沉淀,故D正确;
故选项为:C.
点评:根据所给的问题情景及相关信息,结合所学的相关知识和技能,联系起来细心地探究、推理后,按照题目要求进行选择或解答即可,注意抓住图象的起始点、转折点、终点及变化趋势判断.