按要求写出化学方程式并回答有关问题:
(1)水在通电时发生电解:________.在该实验中,可看到正极与负极两气体的体积比是________;
(2)细铁丝在纯氧气中燃烧:________.在实验可以看到________,放热,并生成黑色固体.
(3)燃烧发出耀眼的白光,可作照明弹用的反应:________.
(4)随着社会的进步,我国的汽车工业发展迅速.现在汽车的安全性增加了,尾气的排放更加符合国际标准.围绕这两项内容,回答下列问题:
①为保证驾乘人员人身安全,增设了安全气囊,汽车的安全气囊在汽车发生一定强度的碰撞时,利用叠氮化钠(NaN3)固体发生分解反应,迅速产生氮气和固态钠,气体充满气囊,以达到保护驾乘人员的目的.写出叠氮化钠分解反应的化学方程式:________.
②催化转化器可有效降低尾气中的CO、NO、NO2和碳氢化合物等有害物质向大气中排放.催化转化器中通常采用铂等贵重金属作催化剂.请写出CO和NO在催化剂的作用下发生反应生成CO2和N2的化学方程式:________.
解:(1)水在通电时发生分解生成氢气和氧气.
该反应的化学方程式为:2H
2O

2H
2↑+O
2↑.
在该实验中,正极产生的是氧气,负极产生的是氢气,两气体的体积比是1:2;
(2)细铁丝在纯氧气中燃烧生成四氧化三铁.
该反应的化学方程式为:3Fe+2O
2
Fe
3O
4.
在实验中可以看到火星四射,放热,并生成黑色固体.
(3)镁燃烧能发出耀眼的白光,是镁与氧气在点燃条件下反应生成氧化镁.
该反应的化学方程式为:2Mg+O
2
2MgO.
(4)①叠氮化钠分解,迅速产生氮气和固态钠.
该反应的化学方程式为:2NaN
3═2Na+3N
2↑.
②CO和NO在催化剂的作用下发生反应生成CO
2和N
2.
该反应的化学方程式为:2CO+2NO
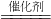
2CO
2+N
2.
故答案为:
(1)2H
2O

2H
2↑+O
2↑;1:2.
(2)3Fe+2O
2
Fe
3O
4;火星四射.
(3)2Mg+O
2
2MgO.
(4)①2NaN
3═2Na+3N
2↑;②2CO+2NO
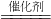
2CO
2+N
2.
分析:书写化学方程式时,必须熟悉反应物、生成物和反应条件,必须依据客观事实、遵守质量守恒定律.
点评:本题主要考查化学方程式的书写,难度较大.

 2H2↑+O2↑.
2H2↑+O2↑. Fe3O4.
Fe3O4. 2MgO.
2MgO.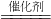 2CO2+N2.
2CO2+N2. 2H2↑+O2↑;1:2.
2H2↑+O2↑;1:2. Fe3O4;火星四射.
Fe3O4;火星四射. 2MgO.
2MgO.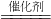 2CO2+N2.
2CO2+N2.

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 20、今年8月奥运会即将在我国举行,奥运五环旗也将在北京飘扬.某校的化学兴趣小组制作了一面化学五环旗,如图,A、B、C、D、E各代表铁、水、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质.常温下相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D.请填空:
20、今年8月奥运会即将在我国举行,奥运五环旗也将在北京飘扬.某校的化学兴趣小组制作了一面化学五环旗,如图,A、B、C、D、E各代表铁、水、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质.常温下相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D.请填空: