解答:解:(1)①比较物质的溶解度大小须确定温度,故错误;
②由图可知:B的溶解度曲线没有C的溶解度随温度变化大,故溶解度B比C受温度影响大错误;
③t
2℃时A、B两物质溶解度曲线交于一点,表示该温度下二者的溶解度一定相等;
④不知该温度下溶质、溶剂的质量,无法判断t
2℃时A、B两溶液溶质质量分数关系,故错误;
⑤据饱和溶液中溶质的质量分数的计算式
×100%,可知:溶解度相等则饱和溶液中溶质的质量分数也就相等,但不知两溶液的质量是否相等,所以t
2℃时A、B两饱和溶液所含溶质质量不一定相等;
⑥不知溶液是否饱和,无法判断溶质的质量分数大小,所以t
1℃时A、B、C三份溶液的溶质质量分数大小关系为B>C>A是错误的;
(2)填空
①观察溶解度曲线可知:t
1℃时A、B、C三种物质的溶解度大小关系为B>C>A,且C的溶解度是60g,所以t
1℃时将质量都为60克的A、B、C三种物质分别放入100克水中,C恰好形成饱和溶液,A形成饱和溶液,且溶质有剩余;
②t
1℃时A、B、C三种物质的溶解度大小关系为B>C>A,即等量的水中溶解三种物质的质量大小关系为B>C>A,故将A、B、C三种物质的饱和溶液分别蒸发10克水,B析出晶体质量最多,析出晶体质量最少的是A;
③由①可知:t
1℃时A的溶解度最小,所以将等质量的A、B、C三种物质分别加水溶解配制成饱和溶液,所需水的质量最大的是 A;
④t
1℃时A 的溶解度是30g,所以50g水中最多溶解A物质 15g;t
1℃时把30g A固体放入50g水中,充分溶解后仍有15gA不溶解,所以得到溶液的质量是65g,所得溶液的溶质质量分数为
×100%≈23.1%,要想在t
1℃时配成溶质质量分数为30%的A溶液,不会成功,因为该温度下A的饱和溶液溶质质量分数最大,是23.1%;
⑤由图可知:AB的溶解度随温度的降低而减小,C的溶解度随温度的降低而增大,所以将t
2℃的A、B、C三份饱和溶液降温到t
1℃时,AB会有晶体析出;
⑥AB的溶解度随温度的降低而减小,C的溶解度随温度的降低而增大,饱和溶液中溶质的质量分数=
×100%,即溶解度越大质量分数也就越大;所以将t
2℃的A、B、C三份饱和溶液降温到t
1℃时,AB析出晶体,溶质质量分数减小,C溶解度变大,溶质、溶剂的质量不变,则溶质的质量分数不变;
⑦据⑥分析可知:将t
2℃的A、B、C三份饱和溶液降温到t
1℃时,AB析出晶体,C降温后溶质质量分数不变,与降温前相等;t
1℃时B的溶解度大于t
2℃时C的溶解度大于t
1℃时A的溶解度,所以降温后三份溶液溶质质量分数由大到小的顺序是B>C>A;将t
1℃的A、B、C三份饱和溶液升温到t
2℃时,AB溶解度增大,溶质质量分数与升温前相等,C析出晶体,溶质质量分数减小,且t
1℃时B的溶解度大于t
2℃时C的溶解度大于t
1℃时A的溶解度,所以三份溶液溶质质量分数由大到小的顺序是B>C>A;
⑧B的溶解度受温度影响不大,A的溶解度受温度影响较大,所以当B中混有少量A时,应该用 蒸发溶剂的方法提纯B;
故答案为:(1)①错;②错;③对;④错;⑤错;⑥错;
(2)①AC;②B;A;③A;④15;65;23.1%;不能成功;⑤AB;⑥AB;无;C;⑦B>C>A;B>C>A;⑧蒸发溶剂.

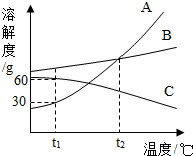 根据如图溶解度曲线回答下列问题:
根据如图溶解度曲线回答下列问题:

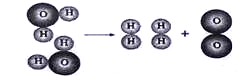 下图是水分子在一定条件下分解的示意图,从中获得的信息正确的是
下图是水分子在一定条件下分解的示意图,从中获得的信息正确的是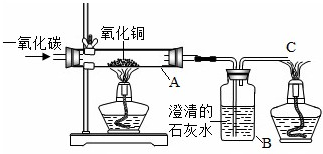 某化学兴趣小组在实验室里用一氧化碳来还原氧化铜(装置如图所示).试回答下列问题:
某化学兴趣小组在实验室里用一氧化碳来还原氧化铜(装置如图所示).试回答下列问题:
