
【题目】我国从1994年开始强制食盐加碘,即在食盐中加入碘酸钾(KIO3),以防治碘缺乏病的发生,今年将适当下调现行食盐加碘量。各地将根据本地区实际情况作相应调整。深圳已率先作出调整,由原来每千克食盐含碘40mg下调至25mg。(提示:碘相对原子质量为127)
(1)碘酸钾相对分子质量为_____________;
(2)碘酸钾中碘元素、钾元素、氧元素的质量比为____________;
(3)碘酸钾中碘元素的质量分数为?(保留至0.1%或用分数表示)_________;
科目:初中化学 来源: 题型:
【题目】如图是某粒子的结构示意图,回答下列问题:
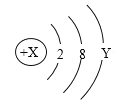
(1)X表示____________ ,Y表示____________;
(2)当X=12时,Y = ____________ ;
(3)当X=17时,该粒子带1个单位负电荷,则Y = ____________;
(4)当Y=1时,该粒子易________(填“得到”或“失去”)电子,变成带 _______(填“正”或“负”)电荷的__________(填“阳离子”或“阴离子”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某小组对 H2O2 溶液制取氧气进行了如下探究:
(探究一)探究不同催化剂对 H2O2分解速率的影响该小组采用了如下图所示装置进行实验,实验中催化剂均为0.4g,H2O2溶液均为20mL,浓度均为 10%。在C框中连接导管和量筒,并测量收集到 50mL 水时的某项数据, 经计算后绘制出下表:
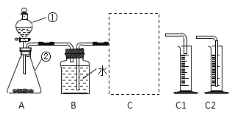
(1)检查 A 装置气密性的方法是:用弹簧夹夹住 A 装置右侧胶皮管,打开①上方的塞子, 向其中加水,打开①的活塞,若__________,则气密性良好。
(2)C 框内选用C1或C2装置,对该探究实验结论有无影响__________。
(3)从实验数据可知:相同条件下,表中催化剂的催化效果由强到弱依次为______。
催化剂种类 | 气体产生速率(mL/s) |
二氧化锰 | 3.5 |
氧化铜 | 4.5 |
活性炭 | 5.8 |
(4)该探究实验中,需要测定的数据是__________。
(5)当量筒中收集到 50mL 水时,H2O2分解产生的氧气体积______50mL(填“大于”、 “等于”、“小于”)。
(探究二)探究 MnO2 的用量对H2O2分解速率的影响下图甲所示装置中产生氧气的量可以用压强传感器测出(在等温条件下,产生氧气体积与装置内压强成正比。反应放热忽略不计)
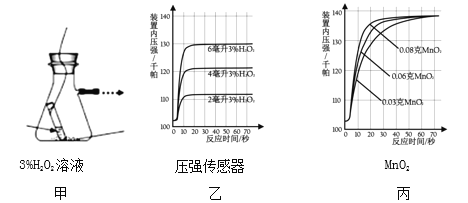
(1)图乙是“0.1gMnO2 与不同体积的 3%H2O2 溶液混合”的实验结果,从图中可以看出______________________。
(2)当用“3%H2O2 溶液 8 毫升与不同质量的 MnO2 混合”时,得到如图丙所示的曲线。曲线的斜率显示,当 MnO2 的用量增加到 0.08g 时,H2O2 的分解速率达到实验要求。在此实验条件下,若MnO2的质量为4g(一药匙)时,能使下图____ (选填字母)烧杯中所装的3%H2O2溶液中 H2O2 的分解速率最接近实验要求。
(探究三)探究 H2O2 溶液的浓度对 H2O2 分解速率的影响如图所示,在250mL三颈瓶中均加入0.5gMnO2,在恒压漏斗中各加入20mL不同浓度的 H2O2 溶液,分别进行实验。用温度传感器测量并绘制出瓶内温度与时间的关系图。如下图 1 所示。再将该装置的三颈瓶浸入水浴池中(该池可使瓶内的溶液温度恒定在 20℃),用上述实验中相同量的各物质重复上述实验,用气压传感器测量并 绘制出瓶内气压与时间的关系图,如下图 2 所示。


不同浓度双氧水催化分解时温度与时间关系图,图 2-不同浓度双氧水催化分解时气压与时间关系图
(1)实验中,恒压漏斗的作用是__________。
(2)由图 1 知道:H2O2分解时会__________热量(填“放出”或“吸收”)。
(3)由图2知道:H2O2溶液浓度越高,H2O2 分解速率越______(填“快”或“慢”)。 以 10%H2O2 溶液为例,约 25S 后三颈瓶内气压由高缓慢降低的原因是_______。
(4)影响 H2O2 分解速率的因素,除了催化剂的种类、催化剂的用量、H2O2 溶液的浓度外,还可能有_______ 、_______等。
查看答案和解析>>
科目:初中化学 来源: 题型:
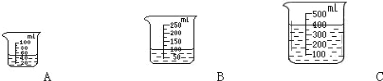
【题目】某兴趣小组的同学在实验室里配制一定溶质质量分数的食盐溶液,下图是配制溶液过程中的部分实验操作,请你完成下列问题:

(1)请你指出实验操作中的错误_________________________;
(2)溶解过程中使用玻璃棒的目的是 ________________________;
(3)配制过程中,导致溶质质量分数偏小的原因,还可能有_________、_________(写两条)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请用化学用语填空:
(1)氯原子_____;(2)地壳中含量最高的金属元素_____; (3)2个硫酸根离子__________;(4)标出氧化亚铁中铁元素的化合价___________;(5)说出O2中“2”表示的意义_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请用所学过的化学知识填空:
(1)人体中含量最多的物质_______(填化学式);
(2)电解水(H2O)生成了氢气(H2)和氧气(O2),说明水是由______________组成的;
(3)实验室常用澄清石灰水检验二氧化碳,其原理是澄清石灰水中的氢氧化钙和二氧化碳反应生成不溶于水的白色固体碳酸钙。氢氧化钙的化学式是Ca(OH)2,其相对分子质量为_______;
(4)1个氟原子的质量为3.156×10-26Kg,一个碳(碳-12)原子的质量为1.993×10-26Kg,则氟的相对原子质量为______(计算结果保留整数);
(5)若相对原子质量为M的原子,核外有N个电子,其核内中子数为是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题:
| I A | II A | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)画出16号元素的原子结构示意图_______,其阴离子符号是_____,其相对原子质量___。
(2)表中3至10号元素位于第二周期,11至18号元素位于第三周期,从原子结构示意图分析其规律可知,每一周期元素原子的_____________ 相同。
(3)表中9号和17号元素最外层电子数相同,都易________(填“得到”或“失去”)电子,则钠元素和氟元素组成的化合物的化学式为________。第11号元素与第17号元素能组成化合物,构成该物质的微粒是____(选填“分子”、“原子”或“离子”)。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是__________(填标号)。
a. C和Ne b. Be和Mg c. Al和Si d. F和Cl
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】海水是一种重要的自然资源。以下是对海水资源的部分利用。
目前世界上60%的镁是从海水中提取的。其主要步骤如下:

(1)提取Mg的过程中,试剂A可以选用_________,写出氢氧化镁沉淀与试剂B反应的化学方程式 。
(2)分离出Mg(OH)2后的NaCl溶液中还含有CaCl2、Na2SO4等杂质,为了获得NaCl溶液,在分离后的溶液中依次加入过量的BaCl2溶液、Na2CO3溶液,过滤,再向滤液中加入适量盐酸。实验中加入过量Na2CO3溶液的目的是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在化学方程式aC2H5OH+bO2![]() mCO2+nH2O中。各化学计量数间的关系正确的是( )。
mCO2+nH2O中。各化学计量数间的关系正确的是( )。
A. a+b=m+n B. a+2b=2m+n C. a=2m D. n=3a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com