
分析 (1)根据化合物中正负化合价的代数和为零结合镍元素和氢氧根的化合价来书写化学式;
(2)将硫酸镍溶液加入试管中,再滴加足量氢氧化钠溶液后,硫酸镍要和氢氧化钠反应生成绿色的氢氧化镍沉淀,同时由于消耗了硫酸镍,所以溶液的颜色要变为无色,可以据此完成该题的解答.
解答 解:(1)镍元素的化合价为+2,而氢氧根的化合价为-1,所以根据化合物中正负化合价的代数和为零可以知道氢氧化镍的化学式为Ni(OH)2;
(2)将硫酸镍溶液加入试管中,再滴加足量氢氧化钠溶液后,硫酸镍要和氢氧化钠反应生成绿色的氢氧化镍沉淀,同时由于消耗了硫酸镍,所以溶液的颜色要变为无色,该反应的化学方程式为:NiSO4+2NaOH═Ni(OH)2↓+Na2SO4,该反应属于复分解反应.
故答案为:(1)Ni(OH)2;(2)①NiSO4+2NaOH═Ni(OH)2↓+Na2SO4;复分解反应;②有绿色固体生成,溶液从绿色变成无色.
点评 要想解答好这类题目,首先,要理解和熟记碱的化学性质、反应现象和化学方程式,以及与之相关的知识.然后,根据所给的实验、问题情景,结合所学的相关知识和技能,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.


科目:初中化学 来源: 题型:实验探究题
| 盐 | K2CO3 | NaCl | CuSO4 | Na2SO4 | FeCl3 | KNO3 |
| pH | 10 | 7 | 4 | 7 | 3 | 7 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | 稀硫酸 | 铜 | 过滤 |
| B | CO2 | SO2 | 通入氢氧化钠后收集 |
| C | FeCl2溶液 | CuCl2 | 过量铁粉、过滤 |
| D | CuSO4 | 稀硫酸 | 加入过量CuO粉末充分反应后、过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NaNO3、NaCl、FeCl3 | B. | HCl、KOH、NaCl | ||
| C. | NaOH、Na2CO3、NaCl | D. | CuSO4、H2SO4、NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
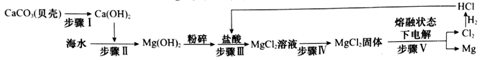
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
| 稀硫酸用量 | 剩余固体质量 |
| 第一次加入10g | mg |
| 第二次加入10g | 2.0g |
| 第三次加入10g | 1.5g |
| 第四次加入10g | 1.0g |
| 第五次加入10g | 0.6g |
| 第六次加入10g | 0.6g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com