
分析 由铁矿石的质量、氧化铁的质量分数、生铁中铁的质量分数,根据赤铁矿炼铁的化学方程式可以列式计算出炼出生铁的质量.
解答 解:设可炼出含铁质量分数为96%的生铁的质量为x.
Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
160 112
100t×85% 96%•x
$\frac{160}{100t×85%}=\frac{112}{96%•x}$
x≈61.98t
答:可炼出含铁质量分数为96%的生铁的质量为61.98t.
点评 本题难度不大,考查含杂质物质的化学方程式的计算,注意代入方程式计算的必须是纯物质的质量是正确解答此类题的关键.


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
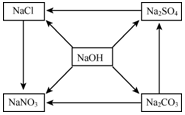 有五种化合物,它们两两之间发生的某些转化关系如图箭头所示.请回答:
有五种化合物,它们两两之间发生的某些转化关系如图箭头所示.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答
水中重要的物质,在实验室中常用于溶解物质、配制溶液.向50mL水(密度为1g•mL-1)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象溶解度表回答| 温度℃ | 0 | 10 | 20 | T2 | 40 | 50 |
| 溶解度g | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
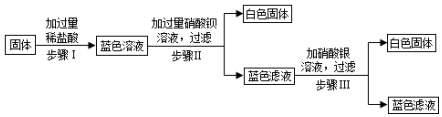
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
 在硫酸与硫酸铜的混合溶液200克中,滴入40%的氢氧化钠溶液100克,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化你溶液的质量关系如图所示.
在硫酸与硫酸铜的混合溶液200克中,滴入40%的氢氧化钠溶液100克,恰好完全反应.记录反应过程,得到的沉淀与所加的氢氧化你溶液的质量关系如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
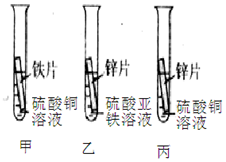 小晨和化学兴趣小组的同学为探究铁、铜、锌的金属活动性顺序,设计了如图三个实验(其中金属均已打磨、其形状、大小及溶液的用量均相同).
小晨和化学兴趣小组的同学为探究铁、铜、锌的金属活动性顺序,设计了如图三个实验(其中金属均已打磨、其形状、大小及溶液的用量均相同).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com