
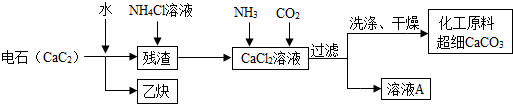


科目:初中化学 来源: 题型:
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量/g | 20 | m | 20 | 20 |
| 反应后质量/g | 2 | 待测 | 32 | 26 |
| A、参加反应的甲、丙、丁的质量比为1:16:13 |
| B、乙可能是该反应的催化剂 |
| C、待测物质一定为4g |
| D、该反应是化合反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:
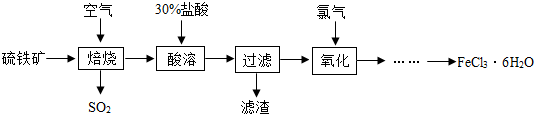
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源.
南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源.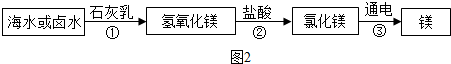
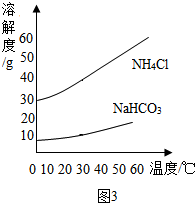
查看答案和解析>>
科目:初中化学 来源: 题型:
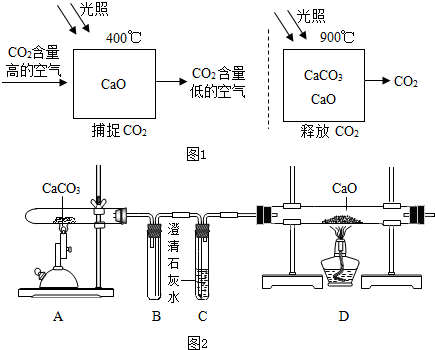
| 实验步骤 | 实验现象 | 实验结论 |
| 猜想Ⅱ成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度 /g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
| Ca(OH)2 | 0.187 | 0.178 | 0.165 | 0.153 | 0.141 | 0.129 | 0.116 | |
查看答案和解析>>
科目:初中化学 来源: 题型:
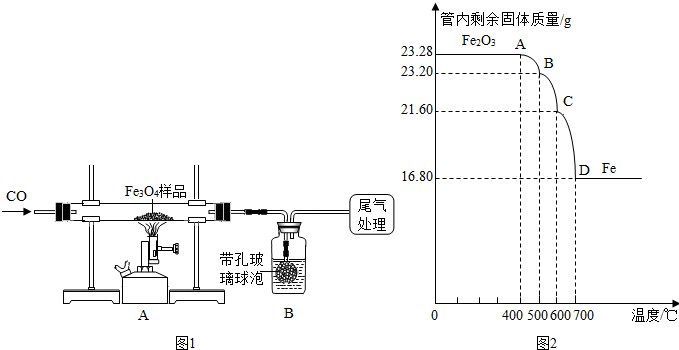
查看答案和解析>>
科目:初中化学 来源: 题型:
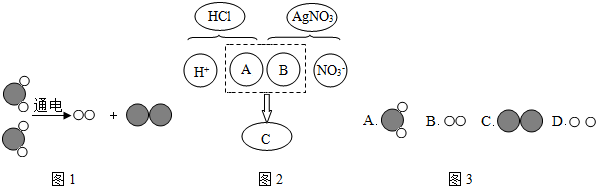
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com