
| 温度/℃ | 20 | 30 | 50 | 60 | 80 | |
| 溶解度/g | K2CO3 | 110 | 114科网] | 121 | 126 | 139 |
| KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |



科目:初中化学 来源: 题型:阅读理解

| 物质 | 镁与冷水 | 铁与冷水 | 铁与水蒸气 | 铜与冷水 | 铜与水蒸气 |
| 反应情况 | 缓慢反应 | 不反应 | 能反应 | 不反应 | 不反应 |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| 紧缺性 | 极度缺水 | 重度缺水 | 中度缺水 | 轻度缺水 |
| 人均水量/(米3/年) | <500 | 500~1000 | 1000~1700 | 1700~3000 |
| 资料一:我国部分省市人均水量图 | ||||
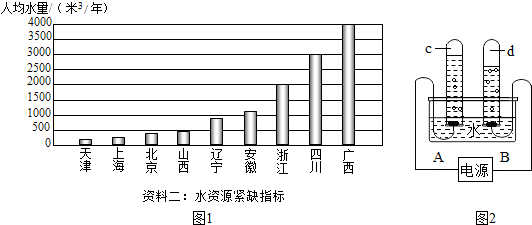
查看答案和解析>>
科目:初中化学 来源: 题型:
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 溶解度/g | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 | 0.13 | 0.12 |
查看答案和解析>>
科目:初中化学 来源: 题型:
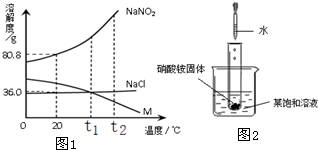
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com