
【题目】用化学用语填空:
(1)硅元素_______________;
(2)三个二氧化硫分子______________________;
(3)镁离子_______________;
(4)氢氧根离子______________________;
(5)硫酸铁_______________;
(6)氧化铝中铝元素化合价__________________。
【答案】Si 3SO2 Mg2+ OH- Fe2(SO4)3 ![]()
【解析】
(1)书写元素符号注意“一大二小”,硅的元素符号是Si。
(2)由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则三个二氧化硫分子可表示为:3SO2。
(3)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。镁离子可表示为:Mg2+。
(4)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略。氢氧根离子可表示为:OH-。
(5)硫酸铁中铁元素显+3价,硫酸根显-2价,其化学式为:Fe2(SO4)3。
(6)氧化铝中铝元素化合价为+3价;由化合价的表示方法,在该元素的上方用正负号和数字表示,正负号在前,数字在后,故氧化铝中铝元素化合价可表示为:
![]()


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】(1)用化学符号表示:
①2个镁离子______________;
②氧化铁中+3价的铁元素_________;
③保持氨气化学性质的最小粒子 ___________;
④天然气的主要成分______。
(2)从下列物质中选择合适的物质,并将序号填在横线上:
A小苏打; B熟石灰; C明矾; D氯化钠。
①可用于净水的是_______;
②常用于改良酸性土壤的是______;
③腌制鱼肉等常用的调味品 _________;
④治疗胃酸过多_________。
(3)完成下列变化的化学方程式
①“曾青(硫酸铜)得铁则化铜”:________ ;
②氢气在空气中燃烧:___________ ;
③实验室加热高锰酸钾制氧气:___________ ;
④稀硫酸与氢氧化钠中和:____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是实验室制取气体的部分装置.
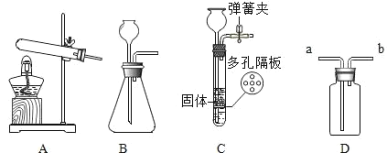
(1)写出一个用 A 装置制取氧气的化学方程式___________________________.
(2)B 和 C 装置均可制取 CO2,其中 C 装置与 B 装置相比优点是___________________________?
(3)若用 D 装置收集 H2,则 H2 应从_____端通入(填“a”或“b”).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定镁和硫酸镁固体混合物中镁元素的质量分数,先称取混合物10g,放入一干净的烧杯中,然后取一定溶质质量分数的稀硫酸100g,平均分五次加入其中,充分振荡,实验所得数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀硫酸的质量/g | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量/g | 0.12 | x | 0.36 | 0.4 | y |
(1)上表中x=_______、y=_______.
(2)固体混合物中镁元素的质量分数为__________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】金属材料是现代生活和工业生产中应用极为普遍的一类物质。请回答下列有关问题。
(1)铁的金属活动性比较强,在潮湿的空气中容易生锈,给人类造成巨大的损失。请写出一种常用的铁的防锈方法:________。
(2)铬是一种重要的金属材料,常用于制造合金。某同学把一片表面用砂纸打磨过的金属铬放入稀酸中,发现铬片表面缓慢产生气泡,由此可得出铬与硫酸铜溶液____(选填能“或“不能”)反应,理由是_______。
(3)某化工厂的废液中含有硝酸银、硝酸亚铁。某同学取适量的上述废液样品,加入一定质量的锌粉充分反应后过滤,得到滤液和滤渣。请填空:
①若得到的滤液为无色,则滤渣中一定含有_______(填化学式)
②若得到的滤液为浅绿色,则滤液中的溶质至少有_______种。
③当得到的滤液为浅绿色时,设计一个简单实验,检验对应滤渣的成分。___________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向盛有一定质量稀硫酸的烧杯中逐渐加入10g锌粒(已知Zn + H2SO4=ZnSO4+H2↑),产生气体质量与锌粒质量的关系如图所示;充分反应后,称得烧杯中剩余物质总质量为109.8g。请根据关系图分析并计算:

(1)稀硫酸反应完时,产生氢气的质量为 ________g
(2)计算消耗锌粒的质量(写出计算过程) ________。
(3)计算原稀硫酸溶液的质量 ________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】高纯度的氧化钙是电子工业中的重要原料.用优质的大理石(主要成分是CaCO3)制备高纯度的氧化钙的流程如图:
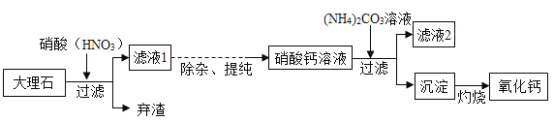
回答下列问题:
(1)大理石与硝酸反应的现象是_________.
(2)加入(NH4)2CO3溶液时发生反应的化学方程式是______________.
(3)将滤液2经过蒸发浓缩、__、过滤,可得到氮肥晶体.
(4)含CaCO3的质量分数90%的大理石1000kg经过上述流程,若不考虑钙元素的损失,理论上可以得到氧化钙__ kg.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某工厂排出的无色废液中,可能含有HCl、![]() 、NaCl、NaOH、
、NaCl、NaOH、![]() 中的一种或几种。为测定其成分,某课外小组的同学做了如下实验
中的一种或几种。为测定其成分,某课外小组的同学做了如下实验
(1)测得该废液的pH为11,则可确定废液中一定不含什么物质________?
(2)若向废液中加入![]() 溶液,产生白色沉淀,请用化学方程式解释________。
溶液,产生白色沉淀,请用化学方程式解释________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图象能正确反映其对应关系的是( )
A.向一定量pH=3的硫酸溶液中不断加水稀释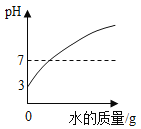
B.向一定量的饱和石灰水中不断加入生石灰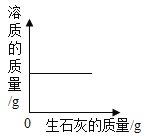
C.向盛有相同质量的镁和氧化镁的烧杯中分别加入相同溶质质量分数的稀盐酸至过量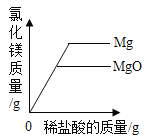
D.等质量的铁片、铝片分别与足量且质量分数相同的稀硫酸反应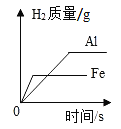
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com