
水和溶液在生命活动和生活中起着十分重要的作用。
(1)海水中含有大量的氯化钠,可以通过 方法获得粗盐,粗盐提纯得到精盐。
(2)0.9%的氯化钠溶液称作生理盐水,其溶质是 。若用10%的NaCl溶液来配制
100 g 0.9%的氯化钠溶液,需加水 g。
(3)熟石灰在部分温度下的溶解度如下表所示。
|
温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
溶解度/g |
0.18 |
0.17 |
0.16 |
0.15 |
0.14 |
0.13 |
0.12 |
①20℃时,0.56 g氧化钙放入到盛有100 g水的烧杯中。恢复到20℃时,所得溶液中水的质量 (填“增大”、“减小”或“不变”),溶液中溶质的质量分数是 (写计算式)。
②采用一种操作方法,将上述烧杯中剩余固体全部溶解,变为不饱和溶液。下列说法正确的是 。
A.溶液的质量可能不变 B.溶液中溶质的质量分数一定减小
C.溶液中溶质的质量一定增大 D.可以升温使之变成不饱和溶液
(1)蒸发溶剂 (2)氯化钠 91
(3)①减小  ②BC
②BC
【解析】(1)可以通过蒸发溶剂的方法获得粗盐
(2)根据溶质质量=溶液质量×溶质的质量分数=100g×0.9%=0.9g,10%的生理盐水的溶液质量=0.9/ 10% =9g,加水的质量=100 g -9 g =91 g
(3)氧化钙和生成氢氧化钙,溶液中水的质量减小,0.56 g氧化钙和水生成0.74 g的氢氧化钙,20℃时氢氧化钙的溶解度是0.16 g,所以溶液中溶质质量=0.16 g,溶液中溶质的质量分数= ,②依据氢氧化钙的溶解度随温度变化的关系可知,氢氧化钙的溶解度随温度变化很不明显,所以剩余固体全部溶解,变为不饱和溶液只能采用加入溶剂的办法完成,所以溶液的溶质质量分数会变小,溶质的质量增大
,②依据氢氧化钙的溶解度随温度变化的关系可知,氢氧化钙的溶解度随温度变化很不明显,所以剩余固体全部溶解,变为不饱和溶液只能采用加入溶剂的办法完成,所以溶液的溶质质量分数会变小,溶质的质量增大


科目:初中化学 来源: 题型:
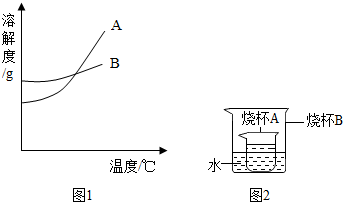 (2013?通州区一模)水和溶液在生命活动和生活中起着十分重要的作用.根据下面的溶解度表与溶解度曲线(图1),回答下列问题:
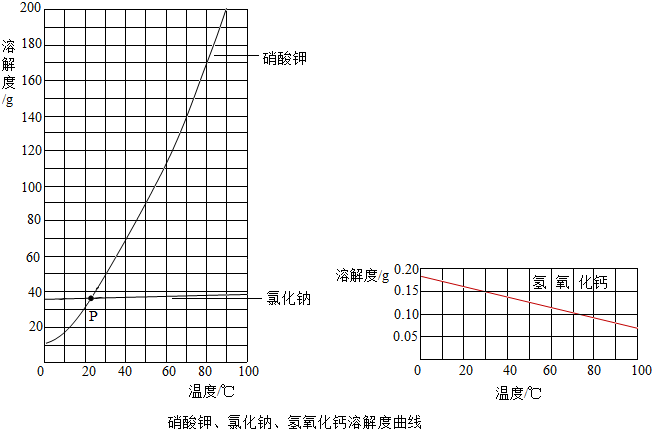
(2013?通州区一模)水和溶液在生命活动和生活中起着十分重要的作用.根据下面的溶解度表与溶解度曲线(图1),回答下列问题:| 温度/°C 溶解度/g |
0 | 20 | 40 | 60 | 80 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| Ca(OH)2 | 0.173 | 0.165 | 0.121 | 0.116 | 0.094 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?昌平区二模)水和溶液在生命活动和生产、生活中起着十分重要的作用.
(2012?昌平区二模)水和溶液在生命活动和生产、生活中起着十分重要的作用.
| ||
| ||
| 溶液的温度/℃ | 75 | 65 | 50 | 35 | 20 |
| 析出固体M的质量/g | 0 | 0 | 2.0 | 4.5 | 8.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 水和溶液在生命活动和生活中起着十分重要的作用.根据下面的溶解度表与
水和溶液在生命活动和生活中起着十分重要的作用.根据下面的溶解度表与| 温度/℃ 溶解度/g |
0 | 20 | 40 | 60 | 80 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
查看答案和解析>>
科目:初中化学 来源:2012届北京市昌平区中考二模化学试卷 题型:填空题
(6分)水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)净水器中经常使用活性炭,主要利用活性炭的_______性。
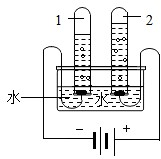
(2)根据图中实验只生成了氢气和氧气,确定水是由氢元素和氧元素组成的,得到此结论的依据是________。写出此实验中发生反应的化学方程式________。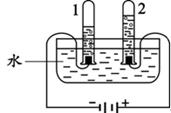
(3)烧杯中盛有一定质量、温度为80℃、溶质为M的溶液,将其置于室温环境中,测定不同温度时析出固体M的质量。测定结果记录如下表。
| 溶液的温度/℃ | 75 | 65 | 50 | 35 | 20 |
| 析出固体M的质量/g | 0 | 0 | 2.0 | 4.5 | 8.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com