
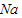 +
+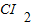 =2
=2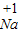
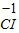 ��Ӧǰ��Na��Cl�Ļ��ϼ۷����˱仯���÷�Ӧ��������ԭ��Ӧ��
��Ӧǰ��Na��Cl�Ļ��ϼ۷����˱仯���÷�Ӧ��������ԭ��Ӧ�� 2KCl+3O2�� D��CaCO3
2KCl+3O2�� D��CaCO3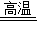 CaO+CO2��
CaO+CO2�� Cu+H2O F��HCl+NaOH=NaCl+H2O
Cu+H2O F��HCl+NaOH=NaCl+H2O

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ��� | ��ѧ����ʽ | ���ڵĻ�����Ӧ���� | ||||
| 1 | Fe+S
|
Combination reaction | ||||
| 2 | Cu��OH��2
|
Deconpostition reaction | ||||
| 3 | H2+CuO
|
Displacenent reaction | ||||
| 4 | HCl+AgNO3=AgCl��+HNO3 | Double deconposition reaction |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 0 |
| Na |
| 0 |
| Cl |
| +1 |
| Na |
| -1 |
| Cl |
| ||
| ||
| �� |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 0 |
| Na |
| 0 |
| Cl2 |
| +1 |
| Na |
| +1 |
| Cl |
| ||
| A |
| ||
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com