




分析 【迁移运用】根据硫酸钠溶液能导电,是因为硫酸钠在水溶液中会电离出钠离子和硫酸根离子进行分析;
【探索发现】(1)根据氢氧化钠和盐酸反应生成氯化钠和水进行分析;
(2)根据氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,硫酸根离子和钡离子生成了难溶于水的硫酸钡沉淀进行分析;
(3)根据氢离子和碳酸根离子生成了水和二氧化碳进行分析;
【总结规律】根据复分解反应的条件进行分析;
【知识深化】根据铝和硫酸铜反应生成硫酸铝和铜进行分析;
【能力提升】(1)根据氯化钡和硫酸钠反应的实质是钡离子和硫酸根离子生成了硫酸钡沉淀进行分析;
(2)根据硫酸在水溶液中会电离出氢离子和硫酸根离子,以及硫酸和氢氧化钡反应的溶质离子数目的变化进行分析.
解答 解:【迁移运用】硫酸钠溶液能导电,原因是硫酸钠溶于水,能电离出钠离子和硫酸根离子,所以Na2SO4→2Na++SO42-;
【探索发现】(1)氢氧化钠和盐酸反应生成氯化钠和水,化学方程式为:NaOH+HCl=NaCl+H20,该反应属于复分解反应;
(2)氯化钡和硫酸钠反应生成硫酸钡沉淀和氯化钠,化学方程式为:BaCl2+Na2SO4=BaS04↓+2NaCl,硫酸根离子和钡离子生成了难溶于水的硫酸钡沉淀,所以反应能进行的原因是溶液中Ba2+和SO42-的数目减少;
(3)Na2CO3和HCl的实质是:氢离子和碳酸根离子生成水和二氧化碳,所以反应实质是:2H++CO32-→H2O+CO2↑;
【总结规律】复分解反应能发生的本质原因是:溶液中自由移动的离子结合成难以电离的物质,从而使自由移动的离子数目减少;
【知识深化】铝和硫酸铜反应生成硫酸铝和铜,化学方程式为:Al+3CuSO4=Al2(SO4)3+3Cu,从微观粒子变化的角度分析铝片在硫酸铜溶液中发生的变化:铝原子失去电子变成铝离子,铜离子得到电子变成铜原子;
【能力提升】(1)氯化钡和硫酸钠反应的实质是钡离子和硫酸根离子生成了硫酸钡沉淀,所以Ba2++S${{O}_{4}}^{2-}$=BaSO4;
(2)硫酸在水溶液中会电离出H+、S${{O}_{4}}^{2-}$,向稀硫酸溶液中逐渐加入氢氧化钡溶液后,溶液导电能力会先减弱再增强,理由是:随着氢氧化钡溶液的加入,溶液中存在自由移动的离子数目越来越少,导电能力逐渐减弱,当两者恰好完全反应后,随着氢氧化钡溶液的加入,溶液中自由移动的离子数目又会逐渐增多,导电能力又逐渐增强.
故答案为:【迁移运用】2Na++SO42-;
【探索发现】(1)NaOH+HCl=NaCl+H20,复分解;
(2)BaCl2+Na2SO4=BaS04↓+2NaCl,Ba2+和SO42-;
(3)H2O+CO2↑;
【总结规律】溶液中自由移动的离子结合成难以电离的物质,从而使自由移动的离子数目减少;
【知识深化】Al+3CuSO4=Al2(SO4)3+3Cu,铝原子失去电子变成铝离子,铜离子得到电子变成铜原子;
【能力提升】(1)Ba2++S${{O}_{4}}^{2-}$=BaSO4;
(2)H+、S${{O}_{4}}^{2-}$,先减弱再增强,随着氢氧化钡溶液的加入,溶液中存在自由移动的离子数目越来越少,导电能力逐渐减弱,当两者恰好完全反应后,随着氢氧化钡溶液的加入,溶液中自由移动的离子数目又会逐渐增多,导电能力又逐渐增强.
点评 本考点考查了复分解反应的实质、实验设计和化学方程式的书写,有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;书写化学方程式要注意配平.


科目:初中化学 来源: 题型:选择题
| A. | 物质与氧气发生的反应都是氧化反应 | |
| B. | 点燃氢气时发生爆炸,可能是因为没有检验氢气的纯度 | |
| C. | 铁生锈属于缓慢反应 | |
| D. | 凡是氧化反应都是化合反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 2009年春节联欢晚会上,刘谦的魔术表演激起了人们强烈的好奇心,并在全国范围内 掀起了魔术表演的热潮.在学校科技节活动中,一位九年级同学给低年级同学表演了一组化学小魔术,请你利用所学化学知识揭开其中之谜.
2009年春节联欢晚会上,刘谦的魔术表演激起了人们强烈的好奇心,并在全国范围内 掀起了魔术表演的热潮.在学校科技节活动中,一位九年级同学给低年级同学表演了一组化学小魔术,请你利用所学化学知识揭开其中之谜.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 测量项目 | 实验前 | 实验后 | |
| 烧杯中水的体积 | 烧杯中剩余水的体积 | 集气瓶(扣除内容物)和导管的容积 | |
| 体积/mL | 80.0 | 54.5 | 126.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
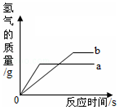 将等质量的锌粉和铁粉分别与溶质质量分数相同且等质量的稀硫酸充分反应,产生氢气的质量与时间的关系如图所示.充分反应后,表示锌粉与稀硫酸反应的曲线是:a(填a或b),若有一种金属有剩余,则剩余的金属一定是Fe(填化学式)
将等质量的锌粉和铁粉分别与溶质质量分数相同且等质量的稀硫酸充分反应,产生氢气的质量与时间的关系如图所示.充分反应后,表示锌粉与稀硫酸反应的曲线是:a(填a或b),若有一种金属有剩余,则剩余的金属一定是Fe(填化学式)查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com