
 如图是某品牌葡萄糖酸锌口服液的标签,请根据标签信息回答:
如图是某品牌葡萄糖酸锌口服液的标签,请根据标签信息回答: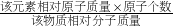 ×100%,可得葡萄糖酸锌中Zn元素的质量分数为:
×100%,可得葡萄糖酸锌中Zn元素的质量分数为: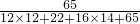 ×100%=14.29%,
×100%=14.29%,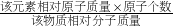 ×100%,进行解答;
×100%,进行解答;

科目:初中化学 来源: 题型:
 (2012?攀枝花)锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂.如图是某品牌葡萄糖酸锌口服液的标签.
(2012?攀枝花)锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂.如图是某品牌葡萄糖酸锌口服液的标签.查看答案和解析>>
科目:初中化学 来源: 题型:
 锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂.如图是某品牌葡萄糖酸锌口服液的标签.请根据标签信息回答问题:
锌是人体健康所必需的元素,葡萄糖酸锌是一种常用的补锌剂.如图是某品牌葡萄糖酸锌口服液的标签.请根据标签信息回答问题:查看答案和解析>>
科目:初中化学 来源: 题型:
 锌是人体健康必需的元素,锌缺乏容易造成发育障碍,易患异食癖等病症,使人体免疫功能低下.市售的葡萄糖酸锌口服液对治疗锌缺乏病具有较好的疗效.如图是某品牌葡萄糖酸锌口服液的标签,请根据标签信息回答:
锌是人体健康必需的元素,锌缺乏容易造成发育障碍,易患异食癖等病症,使人体免疫功能低下.市售的葡萄糖酸锌口服液对治疗锌缺乏病具有较好的疗效.如图是某品牌葡萄糖酸锌口服液的标签,请根据标签信息回答:查看答案和解析>>
科目:初中化学 来源: 题型:
 (2011?天水)锌是人体健康必需的元素,锌缺乏容易造成发育障碍,易患异食癖等病症,使人体免疫力功能低下.药店出售的葡萄糖酸锌口服液对治疗锌缺乏病具有较好的疗效.如图是某品牌葡萄糖酸锌口服液的标签,请根据标签信息回答:
(2011?天水)锌是人体健康必需的元素,锌缺乏容易造成发育障碍,易患异食癖等病症,使人体免疫力功能低下.药店出售的葡萄糖酸锌口服液对治疗锌缺乏病具有较好的疗效.如图是某品牌葡萄糖酸锌口服液的标签,请根据标签信息回答:查看答案和解析>>
科目:初中化学 来源: 题型:
 如图是某品牌葡萄糖酸锌口服液的标签,请根据标签信息回答:
如图是某品牌葡萄糖酸锌口服液的标签,请根据标签信息回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com