
(4分)为测定一瓶放置已久的烧碱中NaOH含量,某同学取适量的烧碱样品,溶于一定量的水,得到200g溶液,再加入200g稀硫酸(足量)充分搅拌到不再放出气泡为止,称量溶液为395.6g。请计算或回答:
(1)反应产生的CO2的质量为 g。
(2)若所取样品为50.0g,则样品中NaOH的质量分数是多少?(写出计算过程)
(3)现有质量相等的烧碱三份,放置一定时间后,若一份未变质、一份部分变质、一份全部变质(注:变质后的物质都为Na2CO3),当分别与相同质量分数的硫酸充分反应时,需要硫酸的质量相等。其原因是 。
⑴ 4.4
⑵ 解:设所取样品中含有Na2CO3的质量为x
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
106 44
x 4.4g
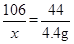 解得:
解得: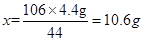
则烧碱样品中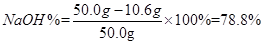
答:烧碱样品中NaOH的质量分数为78.8%
⑶ 依据钠元素质量守恒关系,氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,同时消耗98g硫酸
【解析】
试题分析:由题意可知:
(1) 反应前后,物质质量减少的部分就是反应产生的二氧化碳的质量。故二氧化碳质量为:200+200-395.6=4.4g;
(2) 要求氢氧化钠的质量分数,先得解出碳酸钠的质量。
解:设所取样品中含有Na2CO3的质量为x
Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑
106 44
x 4.4g
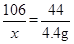 解得:
解得: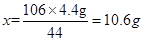
则烧碱样品中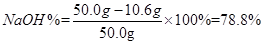
答:烧碱样品中NaOH的质量分数为78.8%
⑶ 根据质量守恒定律可知,钠元素质量在反应前后守恒,氢氧化钠和碳酸钠都是每46g钠元素生成142g硫酸钠,同时消耗98g硫酸,故质量相等的烧碱三份,
若一份未变质、一份部分变质、一份全部变质(注:变质后的物质都为Na2CO3),当分别与相同质量分数的硫酸充分反应时,需要硫酸的质量相等。
考点:根据化学方程式计算;质量分数的计算;质量守恒定律。
点评:根据化学方程式计算,要注意解题的步骤:设、写、找、列、解、答;根据质量守恒定律分析NaOH变质或不变质充分反应所用硫酸的质量是个难点,需要理解质量守恒定律和化学式中元素的质量比才行,难度较大。


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
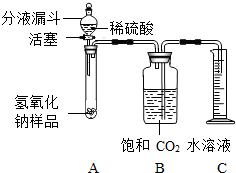
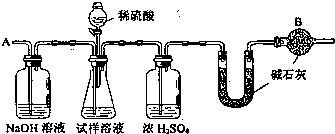
 某学生为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已略去),实验在27℃,101kPa下进行,实验步骤如下:
某学生为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已略去),实验在27℃,101kPa下进行,实验步骤如下:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验步骤 | 相关化学反应方程式 | ||||
| 1.除去空气中粉尘、二氧化碳、干燥后,再除去氧气. | 除去氧气的化学反应方程式为 2Cu+O2
| ||||
| 2.用上述制得的氮气通入装有碳和三氧化二铝硬质玻璃管中高温制取氮化铝样品(如图1). | 装置中发生化学反应的化学方程式为 N2+3C+Al2O3
|
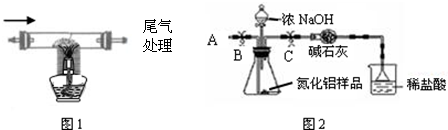
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
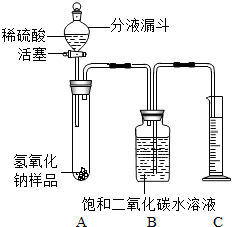
 某学生为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如下图所示的装置(图中铁架台已略去),实验在27℃,101kPa下进行,实验步骤如下:
某学生为了测定实验室中一瓶因保存不善而部分变质的氢氧化钠中碳酸钠的质量分数,设计了如下图所示的装置(图中铁架台已略去),实验在27℃,101kPa下进行,实验步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com