
| A. | 只含碳、氢两种元素 | B. | 只含碳元素 | ||
| C. | 含碳、氢、氧元素 | D. | 可能含氧元素 |
分析 有机物+O2$\stackrel{点燃}{→}$CO2+H2O.反应物的质量总和为4.6g+9.6g=14.2g,生成物的质量总和为8.8g+5.4g=14.2g,根据质量守恒定律可知4.6g此有机物和9.6g氧气全部参加了反应.从定性的角度可推断该有机物中一定含有碳、氢两种元素,可能含有氧元素.要确定此有机物中是否含有氧元素,则要根据质量守恒定律中反应前后元素的质量守恒这一原则,计算出8.8gCO2和5.4gH2O中碳元素、氢元素的质量总和是否等于该有机物的质量,如果8.8gCO2和5.4gH2O中碳元素、氢元素的质量总和小于有机物的质量4.6g,则此有机物中含有氧元素.
解答 解:由质量守恒定律可推断该有机物中一定含有碳、氢两种元素,可能含有氧元素.8.8gCO2中碳元素的质量为8.8g×$\frac{12}{44}$=2.4g,5.4gH2O中氢元素的质量为5.4g×$\frac{2}{18}$=0.6g,
故该有机物中碳元素和氢元素的质量为2.4g+0.6g=3g,小于有机物的质量4.6g,所以该有机物中含有氧元素.
故选C.
点评 本题解题的关键是根据质量守恒定律,反应前后元素种类、质量均相等.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:初中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
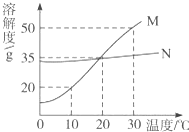 固体物质的溶解性与溶解度之间的关系如下表所示:
固体物质的溶解性与溶解度之间的关系如下表所示:| 20℃时溶解度/g | >10 | 10-1 | 1-0.01 | <0.01 |
| 溶解性 | 易溶 | 可溶 | 微溶 | 难溶 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质.其原理是把蛋白质中的氮元素完全转化成氨气(化学式为:NH3),再用稀硫酸吸收氨气,反应的化学方程式:2NH3+H2SO4=(NH4)2SO4
为了测定某牛奶样品中蛋白质的含量,现采用“盖尔达法”分解其中的蛋白质.其原理是把蛋白质中的氮元素完全转化成氨气(化学式为:NH3),再用稀硫酸吸收氨气,反应的化学方程式:2NH3+H2SO4=(NH4)2SO4查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 :
:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | “真金不怕火炼”是指金的熔点很高,受热不会熔化 | |
| B. | 铁器表面的铁锈具有致密的结构,因此它能保护内部的铁不再锈蚀 | |
| C. | 校内用钢架制作的自行车防雨棚应定期喷涂油漆防锈 | |
| D. | 被腐蚀的铁制品不应该回收 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
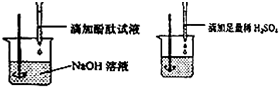
| 实验操作 | 实验现象 | 实验结论 |
| 用试管取该溶液1-2mL,滴加几滴紫色石蕊试液 0,振荡 | 石蕊试液变成红色等 | 溶液呈酸性 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com