
【题目】小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图所示。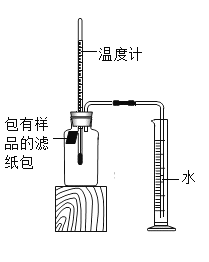
观察到量筒内水沿导管慢慢进入广口瓶(净容积为146ml,当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如表.
序号 | 样品 | 量筒起始读数/mL | 量筒最终读数/mL | 所需时间/min |
1 | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
2 | 1g铁粉.0.2g碳,10滴水和少量NaCl | 100 | 70 | 约70 |
3 |
(1)实验①和②说明NaCl可以______(填“加快”或“减慢”)铁绣蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是_______(填“放热”或“吸热”)过程。
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是______。
(4)实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成。______
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是______%(保留3位有效数字)。
【答案】加快 放热 Fe2O3 1g铁粉、10滴水 20.5%
【解析】
实验①和②说明NaCl能加快铁锈蚀的速率,铁和氧气和水共同作用生成铁锈。
(1)实验①和②之间唯一的变量为是否有NaCl,根据含有NaCl的②组实验,反应所需的时间较短,得到NaCl能加快铁锈蚀的速率。
(2)通过温度升高,可以直接得出铁锈蚀的过程是放热的过程。
(3)铁和氧气和水共同作用生成铁锈,可以判定此物质为铁锈,主要成分为Fe2O3。
(4)“实验①和③是探究碳对铁锈蚀速率的影响”,所以该对照组间唯一的变量应为是否含有碳,因为实验①还有碳,则实验③不含碳,而其它的因素应完全相同,所以实验③的样品组成为1g铁粉、10滴水。
(5)量筒内液体减少的体积即为广口瓶内所含有的全部氧气的体积,所以氧气的体积含量是![]() 。
。


科目:初中化学 来源: 题型:
【题目】某化学学习小组在学习常见的盐的性质后,完成了如下实验。该学习小组对废液杯上层清液的溶质的成分进行了探究。请完成以下探究过程,并将答案填入空白相应位置。
(提出问题)上层清液中含有什么溶质?
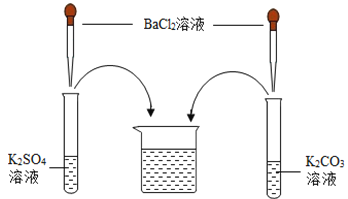
(作出猜想)Ⅰ溶质仅为_____(填化学式);Ⅱ溶质为KCl和BaCl2;Ⅲ溶质为KCl和_____(填化学式);Ⅳ溶质为KCl和K2CO3;Ⅴ溶质为KCl、K2SO4和K2CO3;Ⅵ溶质为KCl、K2SO4、BaCl2和K2CO3。
(交流讨论)小强同学认为猜想Ⅵ一定是错误的,他的理由是_____。
(设计方案)
实验操作 | 现象 | 结论 | |
取少量废液缸中上层清液,分装于甲、乙两支试管中 | 先向甲试管中滴加盐酸至过量 | 无明显现象 | 猜想Ⅳ、Ⅴ不正确 |
再向乙试管中滴加_____溶液(填化学式) | _____ | 猜想Ⅱ正确 | |
(交流反思)学习小组经过讨论认为:实验过程中无须使用AgNO3溶液,其理由是_____(用文字表述)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了测定某铜锌合金中铜的质量分数,某同学利用该合金与稀盐酸反应,进行了三次实验,有关实验数据记录如下(实验中的误差忽略不计)。
第一次 | 第二次 | 第三次 | |
所取合金的质量/g | 25 | 25 | 50 |
所用稀盐酸的质量/g | 120 | 160 | 100 |
生成氢气的质量/g | 0.2 | 0.2 | 0.2 |
(1)分析表格数据可知,合金与所用稀盐酸的质量比为_____时,合金中的锌与稀盐酸中的HCl 恰好完全反应。
(2)试计算该铜锌合金中铜的质量分数_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关化学用语中数字“2”的意义的说法中,错误的是 ( )
①2NaCl ②Mg2+ ③CO2 ④![]() ⑤O2- ⑥H2O2
⑤O2- ⑥H2O2
A.表示化合价数值的是④
B.表示离子所带电荷数的是②⑤
C.表示分子个数的是①
D.表示一个分子中含有某种原子个数的是③⑥
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在负载型钯基催化剂的作用下,通过氢气和氧气直接合成H2O2,其不仅原子利用率高、耗能低,而且副产物只生成水,其反应微观示意图如下,下列有关该反应的说法正确是( )
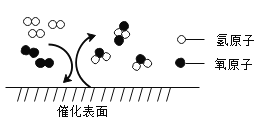
A.该反应属于化合反应
B.负载型钯基在反应前后化学性质发生变化
C.化学反应前后分子种类保持不变
D.该反应符合绿色化学理念
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据金属的化学性质并结合表中信息,填写下表空白。
反应物 | 反应规律 | 反应规律的应用举例 |
金属+O2 | 大多数金属能和O2反应生成金属氧化物 | 铝表面形成一层致密薄膜阻止铝进一步氧化,该薄膜的化学式为________ |
金属+酸 | 在金属活动性顺序里,位于氢前面的金属能与盐酸、稀硫酸发生置换反应,生成盐和H2 | 写出用稀硫酸鉴别黄金和黄铜(铜锌合金) 的化学方程式______ |
金属+盐 | 在金属活动性顺序里,位于前面的金属能把位于后面的金属从它们的盐溶液里置换出来,生成_____ | 用Cu、Mg、Zn中的两种金属分别放 入_____溶液中,即可比较出上述三种金属的活动性强弱 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~F是初中化学常见的物质,已知A、B、C、D、E是五种不同类别的物质,A是空气中含有的一种气体,E是地壳中含量最多的金属元素组成的单质,F为蓝色溶液且各元素质量比为2:1:2,六种物质之间的反应与转化关系均为初中化学常见的化学反应,图中“﹣”表示相连的物质能相互反应,“→”表示一种物质转化成另一种物质(部分反应物、生成物及反应条件已略去)请回答下列问题:
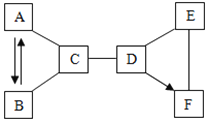
(1)B物质的化学式_____。
(2)A和C反应的化学方程式______。
(3)E和F反应的化学方程式_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学利用下图所示的实验验证稀H2SO4与NaOH溶液能发生中和反应。
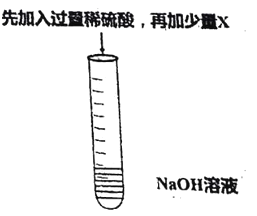
(1)NaOH溶液中存在的大量阳离子是______;
(2)加入稀硫酸后; .试管中发生化学反应的化学方程式______;
(3)为证明稀H2SO4和NaOH溶液能发生反应,x可以是下列物质中的_____。
A 酚酞
B CuSO4
C Na2CO3
D Ba(NO3)2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是实验室制备气体时常用的实验用品,结合图示回答下列问题
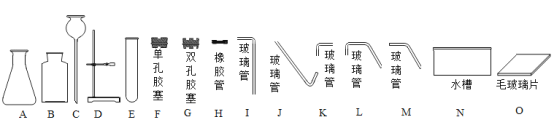
(1)仪器A的名称是_____。
(2)若用稀盐酸和大理石反应制取二氧化碳,并用向上排空气法收集气体,组装整套装置时,可选用整套装置中A C、G、H、I、J、O和____。
(3)若要制取8.8g的CO2,至少需要纯度为80%的大理石_____g;
(4)若选用(2)中的整套装置制取氧气,通常选择的液体药品是______。
(5)选择气体制取装置时,需要考虑_____反应条件和气体的性质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com