
 酸碱盐是初中化学重要的化合物
酸碱盐是初中化学重要的化合物分析 (1)根据对应物质的性质分析溶液的质量变化情况;
(2)根据溶液稀释中溶质的质量保持不变求算加水水的质量,要熟记浓硫酸的稀释的注意事项;
(3)配制溶液的过程为计算、称量、溶解,贴标签等注意常见的误差分析;
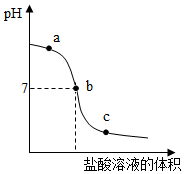
(4)根据起点的pH以及pH变化的趋势分析对应点的溶质情况,进而分析加入指示剂时的颜色变化;
(5)根据沉淀碳酸钙的质量和对应的化学方程式求算碳酸钠的质量,进而求算其质量分数.
解答 解:
(1)①浓盐酸,具有挥发性,导致溶液质量减小;
②浓硫酸:浓硫酸具有吸水性,导致吸收空气中的水分而自身质量增加;
③NaOH溶液:由于和空气的二氧化碳反应生成可溶性的碳酸钠,所以导致质量增加;
④Ca(OH)2溶液:吸收44份质量的二氧化碳生成100份质量的碳酸钙,所以导致溶液质量减小;
⑤NaCl溶液:氯化钠敞口放置在空气中,由于不吸水也不挥发,不和空气中物质反应,所以质量基本不变.
故选:②③.
(2)欲将50g溶质质量分数为98%的浓硫酸稀释成溶质质量分数为19.6%的稀硫酸,设需要水的质量为x
由于溶液稀释过程中溶质的质量不变,可得
50g×98%=(50g+x)×19.6%
x=200g.
由于浓硫酸溶解放热且密度大于水,具有很强的腐蚀性,所以稀释浓硫酸时要注意安全,操作为:将浓硫酸慢慢沿烧杯内壁倒入水中,且用玻璃棒不停搅拌.
(3)用NaOH固体配置50g质量分数为10%的NaOH溶液来制作“叶脉书签”,所需的玻璃仪器有 烧杯、量筒、玻璃棒、胶头滴管,量取水时若仰视读数,导致读读数偏小,液体量取多了,所以会使制得的溶液中溶质的质量分数 偏小;
(4)向氢氧化钠溶液中不断滴入盐酸,得到如图曲线,a点时pH大于7,为碱性,所以溶液中的溶质是剩余的NaOH和生成的NaCl,c点时pH小雨7,为酸性,所以向溶液中加入紫色石蕊溶液呈红色.
(5)设碳酸钠的质量为y
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
y 2g
$\frac{106}{100}$=$\frac{y}{2g}$
y=2.12g
该食用纯碱中Na2CO3的质量分数$\frac{2.12g}{2.5g}$×100%=84.8%.
故答案为:
(1)②③;
(2)200;将浓硫酸慢慢沿烧杯内壁倒入水中,且用玻璃棒不停搅拌.
(3)烧杯、量筒、玻璃棒、胶头滴管;偏小.
(4)NaOH和NaCl; 红.
(5)84.8%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


科目:初中化学 来源: 题型:多选题
| A. | 一氧化碳和二氧化碳的物理性质差异较大,是因为构成他们的原子不同 | |
| B. | 稀有气体的化学性质不活泼,是因为它们的原子最外层电子数都是8个 | |
| C. | 酸、碱、盐中显碱性主要是其溶液中含有OH- (含有OH-溶液都显碱性) | |
| D. | 在一定条件下,高锰酸钾、水都能分解得到氧气,是因为他们都含有氧元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图是人们经常使用的便捷交通工具-自行车.请完成下列各题
如图是人们经常使用的便捷交通工具-自行车.请完成下列各题查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com