
分析 氢氧化钠能和空气中的二氧化碳反应生成碳酸钠和水,碳酸钠能和稀盐酸反应生成氯化钠、水和二氧化碳;
根据生成二氧化碳的质量可以计算碳酸钠的质量,进一步可以计算原混合物中氢氧化钠的质量分数和变质前氢氧化钠固体的质量.
解答 解:设30g溶液中碳酸钠的质量为x,
Na2CO3+2HCl=2NaCl+H2O+CO2↑,
106 44
x 0.44g
$\frac{106}{x}$=$\frac{44}{0.44g}$,
x=1.06g,
60g溶液中碳酸钠的质量为:1.06g÷$\frac{1}{2}$=2.12g,
原混合物中氢氧化钠的质量分数为:$\frac{10g-2.12g}{10g}$×100%=78.8%,
设和二氧化碳反应的氢氧化钠质量为y,
2NaOH+CO2═Na2CO3+H2O,
80 106
y 2.12g
$\frac{80}{y}$=$\frac{106}{2.12g}$,
y=1.6g,
变质前氢氧化钠固体的质量为:1.6g+(10g-2.12g)=9.48g,
答:原混合物中氢氧化钠的质量分数为82.3%,变质前氢氧化钠固体的质量为9.57g.
点评 氢氧化钠暴露在空气中容易变质,因此要密封保存.


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:初中化学 来源: 题型:解答题

| 气体名称 | 收集方法 | 检验方法 |
| 氧气 | 排水法或向上排空气法收集 | 将带火星的木条放在导管口,若木条复燃证明是氧气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 小明同学发现“旺旺雪饼”的包装袋内有一个“小纸袋”,上面写着“食品保鲜剂”,他很好奇,想和同学们对“食品保鲜剂”的成分进行探究.
小明同学发现“旺旺雪饼”的包装袋内有一个“小纸袋”,上面写着“食品保鲜剂”,他很好奇,想和同学们对“食品保鲜剂”的成分进行探究.
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 物质 | 甲 | CuO | CO2 | H2O |
| 反应前质量/g | 待测 | 0 | 0.1 | 0.2 |
| 反应后质量/g | 0 | 16 | 4.5 | 2.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
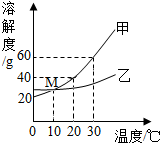
| A. | 30℃时乙的溶解度为60g | B. | 乙的溶解度随温度的升高而降低 | ||
| C. | 20℃时甲的溶解度小于乙的溶解度 | D. | M点表示10℃时两物质的溶解度相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 如图是A、B、C三种物质的溶解度曲线,据图回答:
如图是A、B、C三种物质的溶解度曲线,据图回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com