
| A. | MgCl2、Ca(NO3)2、BaCO3 | B. | AgCl、BaSO4、Na2CO3 | ||
| C. | AlCl3、Cu(OH)2、BaSO4 | D. | Fe(OH)3、BaCO3、AgCl |
分析 碱的溶解性规律:碱溶钾钠钡钙微;盐的溶解性规律:钾盐钠盐铵盐硝酸盐都可溶;盐酸盐中不溶氯化银;硫酸盐中不溶硫酸钡;碳酸盐只溶钾盐、钠盐、铵盐;据此根据碱与盐的溶解性、酸的化学性质进行分析判断.
解答 解:碱的溶解性规律:碱溶钾钠钡钙微;盐的溶解性规律:钾盐钠盐铵盐硝酸盐都可溶;盐酸盐中不溶氯化银;硫酸盐中不溶硫酸钡;碳酸盐只溶钾盐、钠盐、铵盐.
A、MgCl2、Ca(NO3)2均易溶于水,BaCO3难溶于水,故选项错误.
B、AgCl、BaSO4均难溶于水,Na2CO3易溶于水,故选项错误.
C、AlCl3易溶于水,Cu(OH)2、BaSO4均难溶于水,故选项错误.
D、Fe(OH)3、BaCO3、AgCl均难溶于水,故选项正确.
故选:D.
点评 本题难度不大,主要考查常见物质的水溶性,熟记常见盐与碱的溶解性规律是解答本题关健.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:初中化学 来源: 题型:解答题
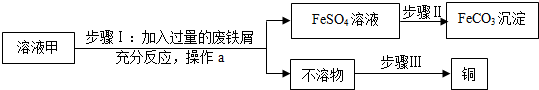
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 属于一种新元素 | B. | 跟普通氢原子相同的原子 | ||
| C. | 是氢元素的另一种原子 | D. | 与氢元素的原子不同类的原子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
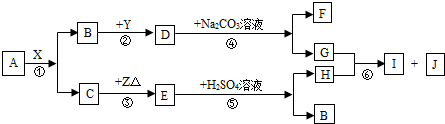
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 氧化反应不一定是化合反应 | B. | 氧化反应一定是化合反应 | ||
| C. | 任何物质燃烧都会发光发热 | D. | 水可以降低燃烧物质的着火点 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氢氧化钠、纯碱、NaOH | B. | 碳酸钙、大理石、CaCO3 | ||
| C. | 氢氧化钙、生石灰、Ca(OH)2 | D. | 氧化钙、熟石灰、CaO |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| O2体积分数 | 90% | 70% | 60% | 55% |
| 实验现象 | 燃烧剧烈、燃烧时间长,效果好 | 燃烧比90%弱,燃烧时间短,实验成功 | 燃烧比70%弱,燃烧时间更短,实验成功 | 难以燃烧,只是发红 |
| 含碳量 | 0 | 0.1% | 0.32% | 0.52% | 0.69% |
| 实验现象 | 无火星四射现象,熔断 | 有短暂火星四射现象,实验欠成功 | 火星四射现象明显,实验成功 | 燃烧比含碳量为0.32%的铁丝剧烈,火星四射更明显,实验成功 | 燃烧比含碳量为0.52%的铁丝更剧烈,火星四射,实验成功 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com