
用下图所示装置,在常温下分别进行探究可燃物燃烧条件和氢氧化钠性质的实验。
已知:白磷的着火点为40℃
内容 装置 | (实验1) 探究可燃物燃烧条件 | (实验2) 探究氢氧化钠性质 |
| I. A中盛有H2O2溶液,B中盛有MnO2,C中盛有80℃的热水和一小块白磷 | I. A中盛有滴有酚酞的 NaOH溶液,B中充满CO2,C中盛有稀硫酸 |
II. 打开分液漏斗活塞,将A中溶液滴加到B中,关闭分液漏斗活塞并打开K | II. 打开分液漏斗活塞,将A中溶液滴加到B中,关闭分液漏斗活塞。充分反应后,打开K |
(1)H2O2溶液与MnO2接触时,发生反应的化学方程式为______。
(2)实验1中,打开K后观察到C中白磷燃烧。该实验证明可燃物燃烧的条件之一是_______。
(3)实验2中,对于所观察到的以下三个实验现象:C中部分液体沿导管流入B中,B中有气泡生成,B中溶液由红色变为无色。解释产生上述现象的主要原因_______(用化学方程式表示)。
2H2O22H2O + O2↑与氧气接触CO2 + 2NaOH = Na2CO3 + H2O、Na2CO3 + H2SO4 = Na2SO4 + H2O + CO2↑(其他答案合理给分) 【解析】 (1)H2O2溶液与MnO2接触时,过氧化氢在二氧化锰做催化剂的条件下生成水和氧气,反应的化学方程式为:2H2O22H2O + O2↑;(2)实验1中,打开K后观察到C中白磷燃烧;该实验证明...科目:初中化学 来源:(人教版)九年级上 化学第一单元课题2 化学是一门以实验为基础的科学 课时练 题型:单选题
在对人体吸入的空气和呼出的气体进行实验探究的过程中,向一瓶空气和一瓶呼出气体中各滴入少量澄清石灰水,振荡,发现只有滴入呼出气体中的澄清石灰水变浑浊,由此得出的结论是( )
A. 吸入的空气中不含二氧化碳
B. 呼出的气体全部是二氧化碳
C. 二氧化碳在呼出气体中的含量比在吸入的空气中的含量高
D. 氧气在呼出气体中的含量比在吸入的空气中的含量低
C 【解析】 A.发现只有滴入到呼出气体中的澄清石灰水变浑浊,说明吸入的空气中二氧化碳含量较低,不能说明吸入的空气中不含二氧化碳,故A错误;B.发现只有滴入到呼出气体中的澄清石灰水变浑浊,说明呼出的气体含有二氧化碳,不能说明呼出的气体全部是二氧化碳,故B错误;C.二氧化碳能使澄清的石灰水变浑浊,向一瓶空气和一瓶呼出气体中各滴入少量澄清石灰水,振荡,发现只有滴入到呼出气体中的澄清石灰水变...查看答案和解析>>
科目:初中化学 来源:四川省眉山市2018年中考化学试卷 题型:单选题
除去下列各物质中含有的少量杂质,所选用的试剂、操作方法都正确的是( )
选项 | 物质 | 杂质 | 试剂 | 操作方法 |
A | Fe | Fe2O3 | 稀盐酸 | 加入足量的稀盐酸,过滤 |
B | FeSO4溶液 | H2SO4 | Fe | 加入过量的铁粉,过滤 |
C | NaOH溶液 | Ca(OH)2 | Na2CO3 | 加入过量Na2CO3溶液,过滤 |
D | KNO3溶液 | K2CO3 | CaCl2 | 加入适量CaCl2溶液,过滤 |
A. A B. B C. C D. D
B 【解析】 A、Fe和Fe2O3均能与稀盐酸反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项所采取的方法错误;B、H2SO4与过量的铁粉反应生成硫酸亚铁溶液和氢气,再过滤,能除去杂质且没有引入新的杂质,符合除杂原则,故选项所采取的方法正确;C、Ca(OH)2能与过量Na2CO3溶液反应生成碳酸钙沉淀和氢氧化钠,能除去杂质但引入了新的杂质碳酸钠(过量的),不符合除杂原则...查看答案和解析>>
科目:初中化学 来源:人教版2018届九年级上册化学:第一单元 课题1 物质的变化和性质 同步练习 题型:单选题
下列有关物质性质和用途的说法错误的是
A. 氮气化学性质稳定,可作保护气
B. 生石灰能吸收水分,可作食品干燥剂
C. 金刚石硬度大,可作钻探机钻头
D. 硫酸呈酸性,可用于去除水垢
D 【解析】 A氮气化学性质稳定,可填充包装袋做保护气;B氧化钙和水反应生成氢氧化钙,因此氧化钙可知食品的干燥剂;C金刚石是自然界中硬度最大的 物质;D硫酸的溶液呈酸性,但是和碳酸钙反应生成微溶的硫酸钙,使反应自动停止;选D查看答案和解析>>
科目:初中化学 来源:人教版2018届九年级上册化学:第一单元 课题1 物质的变化和性质 同步练习 题型:单选题
下列过程属于化学变化的是
A. 石蜡熔化 B. 胆矾被研碎 C. 木头燃烧 D. 水结冰
C 【解析】 属于化学变化的是C.木头燃烧,有新物质生成。A.石蜡熔化,B.胆矾被研碎,D.水结冰, 均没有新物质生成,属于物理变化。查看答案和解析>>
科目:初中化学 来源:北京市昌平区2018届九年级二模化学试卷 题型:简答题
阅读下面科普短文。(原文作者:吴秀玲,原文有删改)
随着生活水平的提高,人们正在不断改善着自己的居家环境,房屋装修越来越普遍。房屋装修会对室内空气质量产生影响,严重时会危害人体健康。为推行“健康住宅”,保障人们的身体健康,国家制定了《室内空气质量标准》,已于2003年3月1日起开始实施。
房屋装修后室内空气污染物的检测
参照国家《室内空气质量标准》GB/T18883—2002,采集60户装修后0~18个月的室内空气样品,检测甲醛、苯、氨的含量(检测前关闭门窗12小时,并打开室内所有橱柜和抽屉,以保证污染物有一个最大释放和平衡过程)。检测结果见下表。
指标 | 甲醛 | 苯 | 氨 |
GB/T18883 —2002(mg/ m3) | ≤0 .10 | ≤0 .11 | ≤0 .20 |
浓度范围(mg/m3) | 0.02-2.19 | 0.01-1.20 | 0-1.86 |
最大超标倍数 | 12.9 | 10 | 5.3 |
超标率(%) | 89 | 50 | 35 |
检测结果分析
(1)室内空气主要污染物及原因
由上表看出,装修后室内空气的首要污染物为甲醛,其次是苯和氨。在超标严重的家庭中,有的是过度装修,有的是购买了大量的新家具,有的是大量使用了人造板材、油漆、粘合剂、乳胶漆等,这些材料会持续向室内释放大量有害气体。
(2)室内空气污染物含量随时间的变化:0~3、5~8、9~12、12~18个月后,室内空气中甲醛、苯、氨含量的超标率随时间变化曲线如下。

(3)室内空气污染物含量的反弹现象
跟踪检测发现,同年11月份室内甲醛浓度为0.15 mg/m3 (室内没有暖气、气温15℃、湿度30%)的房屋,12月份变为0.35 mg/m3 (室内有暖气、气温21℃、湿度35%)。
依据文章内容回答下列问题。
(1)按照国家标准,室内空气中苯的含量不得超过_______mg/m3。
(2)室内空气首要污染物甲醛(HCHO)分子中C、H、O原子个数比为_______。
(3)依据超标率随时间变化的曲线,得到的结论是_______。
(4)引起室内空气污染物含量反弹现象的原因可能是_______。
(5)请你对改善室内空气质量提一条合理化建议_______。
0.111:2:1 内空气污染物的超标率随时间不断增长有明显的下降趋势,最好装修后过18个月再入住(其他答案合理给分)温度、湿度提倡简捷实用的装修、购买环保家具及建材、加强室内通风换气(其他答案合理给分) 【解析】 (1)按照国家标准,室内空气中苯的含量不得超过0.11mg/m3;(2)由甲醛化学式可知,每个甲醛分子中含有1个碳原子,2个氢原子和1个氧原子,故甲醛分子中C、H、O的原子...查看答案和解析>>
科目:初中化学 来源:北京市昌平区2018届九年级二模化学试卷 题型:单选题
X,Y两种固体物质的溶解度曲线如右图所示。下列说法正确的是

A. 两种物质的溶解度X > Y
B. t2℃时,两种物质的饱和溶液中溶质的质量分数X > Y
C. 将t2℃时X的饱和溶液降温至t1℃,溶质质量不变
D. 将t1℃时Y的饱和溶液升温至t2℃,溶质的质量分数增大
B 【解析】 A、在比较物质的溶解度时,需要选定温度,故A错误;B、t2℃时,X物质的溶解度大于Y物质的溶解度,所以两种物质的饱和溶液中溶质的质量分数X>Y,故B正确;C、将t2℃时X的饱和溶液降温至t1℃,溶解度减小,析出晶体,溶质质量减小,故C错误;D、将t1℃时Y的饱和溶液升温至t2℃,不会析出晶体,溶质的质量分数不变,故D错误。故选B。查看答案和解析>>
科目:初中化学 来源:北京市丰台区2018届九年级5月统一测试(一模)化学试卷 题型:流程题
硫酸是用途广泛的化工原料,下图为硫酸工业的主要流程。

请回答下列问题:
(1)沸腾炉中,发生反应的方程式为:4FeS2 + ____ _____= 2Fe2O3 + 8SO2
(2)在接触室发生的反应中,化合价发生改变的元素有____________。
(3)吸收塔中常用98.3%的硫酸吸收SO3,主要反应为SO3 + H2O H2SO4,则所得产品中硫酸的浓度____________98.3%(填“>”、“<”或“=”)。
11 O2S、O> 【解析】 (1)由题可知,该反应是FeS2与氧气反应生成氧化铁和二氧化硫,反应的方程式为4FeS2 + 11O2= 2Fe2O3 + 8SO2,故填11、O2;(2)接触室是二氧化硫与氧气反应生成三氧化硫,二氧化硫中硫元素的化合价为+4价,氧元素的化合价为-2价,氧气中氧元素的化合价为0价,三氧化硫中硫元素的化合价为+3价,氧元素的化合价为-2价,故反应前后化合价发...查看答案和解析>>
科目:初中化学 来源:江苏省苏州市2018届九年级中考二模考试化学试卷 题型:综合题
某同学对CaH2的制备和性质进行探究。
【阅读资料】①用H2与钙加热制得CaH2 ②钙遇水立即发生剧烈反应生成一种碱和一种气体 ③CaH2要密封保存,遇水反应也生成一种碱和一种气体
【CaH2的制备】设计的制取装置如图所示.
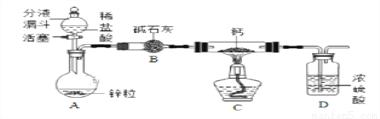
(1)装置B的作用是____________________________;
(2)制备CaH2实验结束后,取少量产物,小心加入水中,观察有气泡产生,在溶液中滴入石蕊试液后显__________色。该同学据此判断:实验中确有氢化钙生成,其他同学提出结论不一定正确,原因是________________________。
【CaH2的性质探究】 取少量上述制得的CaH2 样品加入到足量的碳酸钠溶液中,产生大量气泡,过滤,得到滤渣和滤液。经检验滤渣的成分是碳酸钙。该同学进行了如下的探究。
(3)点燃产生的气体,火焰淡蓝色;将燃烧产物通入澄清石灰水中,无现象。则该气体为_________(写化学式)。
(4)对滤液中溶质的成分做出如下猜测并进行实验:
猜想一:NaOH 猜想二:NaOH、Ca(OH)2 猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因___________________
【实验验证】
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量 Na2CO3溶液 | ____________ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | ________________ | 猜想三成立 |
【定量分析】
取制得的CaH2样品1g(杂质为未反应完的Ca)加入到足量的Na2CO3溶液中,充分反应后,过滤、洗涤、干燥称得CaCO3质量为2.4g,则该样品中CaH2的质量分数为__________(写出计算过程).
吸收水蒸气 蓝色 可能是钙和水反应 H2 Na2CO3+Ca(OH)2= CaCO3+2NaOH 无明显现象 过一会儿有气泡产生 84% 【解析】本题在对CaH2的制备和性质进行探究的情境下考查了获取信息的能力,反应后物质的成分,酸、碱、盐的性质和化学综合计算,综合性较强。首先分析题目中所给的信息,然后结合学过的知识对信息加以整合,依据题意分析问题、解决问题。 CaH2的制备:(1)...查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com