
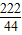 ═
═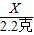
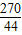 ═
═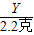
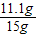 ×100%=74%.
×100%=74%.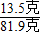 ×100%═16.5%.
×100%═16.5%.

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
(10孝感12)、研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数。现称取15g该铜矿样品放入烧杯中,在逐滴加入稀盐酸至恰好完全反应(假如铜矿中的杂质不予稀盐酸反应,也不溶于水),称得烧杯中剩余物质的质量为85.8g.试求:
(1)铜矿中碱式碳酸铜的质量分数
(2)所得溶液中溶质的质量分数。
(反应的化学方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+ CO2↑+3H2O)
查看答案和解析>>
科目:初中化学 来源:2010年全国中考真题专题汇编专题六 化学方程式计算(二) 题型:计算题
(10孝感12)、研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数。现称取15g该铜矿样品放入烧杯中,在逐滴加入稀盐酸至恰好完全反应(假如铜矿中的杂质不予稀盐酸反应,也不溶于水),称得烧杯中剩余物质的质量为85.8g.试求:
(1)铜矿中碱式碳酸铜的质量分数
(2)所得溶液中溶质的质量分数。
(反应的化学方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+ CO2↑+3H2O)
查看答案和解析>>
科目:初中化学 来源:专项题 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:
研究型学习小组欲测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数。现称取15g该铜矿样品放入烧杯中,在逐滴加入稀盐酸至恰好完全反应(假如铜矿中的杂质不予稀盐酸反应,也不溶于水),称得烧杯中剩余物质的质量为85.8g.试求:
(1)铜矿中碱式碳酸铜的质量分数
(2)所得溶液中溶质的质量分数。
(反应的化学方程式为:Cu2(OH)2CO3+4HCl=2CuCl2+ CO2↑+3H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com