
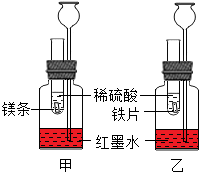
 某化学活动小组探究金属的反应规律.在室温条件下进行如图所示实验.
某化学活动小组探究金属的反应规律.在室温条件下进行如图所示实验.分析 (1)金属越活泼,与稀盐酸或稀硫酸反应时速率越快,产生的气泡越多;
(2)考虑镁反应快放热多,因此甲中长颈漏斗里的液面上升得更快;
(3)当金属过量时,与酸反应生成氢气的质量决定于酸的质量.
解答 解:试管内的镁条和铁片表面均被打磨洁净,且形状、大小相同;同时加入等质量和等质量分数的稀硫酸,甲中反应的方程式为:Mg+H2SO4=MgSO4+H2↑,
(1)因为镁比铁活泼,所以分别于等质量、等质量分数的稀硫酸反应时,镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快.
(2)如图1所示实验的目的是:比较镁、铁分别与盐酸反应放热速度;因为镁反应快放热多,因此甲中长颈漏斗里的液面上升得更快.
(3)若镁和铁均过量,则装置甲中产生的H2的质量等于装置乙中产生的H2质量.
故答案为:Mg+H2SO4=MgSO4+H2↑;
(1)镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快.
(2)因为镁反应快放热多,因此甲中长颈漏斗里的液面上升得更快.
(3)等于.
点评 本题考查质量守恒定律的实验验验证和实验装置的选择,所以正确理解质量守恒定律和根据反应特点,即反应物和生成物中是否有气体或者烟雾,选择什么样的装置是解决本题的关键.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
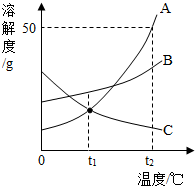 A、B、C三种物质的溶解度曲线如图所示.下列分析正确的是( )
A、B、C三种物质的溶解度曲线如图所示.下列分析正确的是( )| A. | t2℃时,把30gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1:3 | |
| B. | 将t2℃时,A、B、C三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数的大小关系是B>C=A | |
| C. | t1℃时,A、C两种物质的饱和溶液中溶质的质量相等 | |
| D. | 将C的饱和溶液变为不饱和溶液,可采用升温的方法 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 制取气体:先检验装置的气密性,后加入药品 | |
| B. | 点燃可燃性气体:先检验气体的纯度,后点燃 | |
| C. | CO还原氧化铁实验结束时:先停止通CO,后撤离酒精灯停止加热: | |
| D. | 除去N2中混有的CO和CO2:先通过灼热的氧化铜,再通过氢氧化钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 当煤燃烧正旺时将炉门关上,煤层上方发现蓝色火焰.解释:此时氧气不足而产生的一氧化碳在燃烧 | |
| B. | 煤燃烧完后煤灰的质量比煤的质量轻.解释:煤燃烧后产生二氧化碳等气体逸出 | |
| C. | 在煤炉上方放一壶水不能防止一氧化碳中毒.解释:一氧化碳难溶于水 | |
| D. | 将煤做成蜂窝状就更易燃烧.解释:蜂窝状的煤与空气接触面积增大 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 如果两种粒子属于同一种元素,则它们原子核内的质子数一定相等 | |
| B. | 如果两种粒子属于同一种元素,则它们原子核内的中子数一定相等 | |
| C. | 如果两种粒子含有相同的质子数,则它们一定属于同一种元素 | |
| D. | 如果两种粒子含有相同的电子数,则它们一定属于同一种元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
 金属是现代生活和工业生产中应用极为普遍的一类材料.
金属是现代生活和工业生产中应用极为普遍的一类材料.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 除去氧化钙中的碳酸钙 | 加入足量的水溶解,过滤 |
| B | 除去氯化钠固体中的少量碳酸钠 | 加入适量稀盐酸,充分反应后,蒸发 |
| C | 证明酸和碱恰好中和 | 向含有酚酞的氢氧化钠溶液中加入盐酸,溶液最终呈无色 |
| D | 测定久置于空气中的NaOH固体中碳酸钠的含量 | 取ag固体,加入足量稀盐酸,用排水法收集VmL气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com