
【题目】在2016年巴西里约奥运会上,小红与同学发现游泳池池内水呈蓝色,对“蓝色水”产生好奇,于是她用一个洗净的可乐瓶装满一瓶“蓝色水”,进行探究:
[提出问题]“蓝色水”中的溶质是什么?
[猜想]小红经过查阅资料和自己学过的化学知识,她猜溶质可能是_____。
[查阅资料]含有铜离子的溶液一般呈蓝色。碳酸钡、硫酸钡都是白色沉淀,硫酸钡还不溶于稀硝酸。
[设计方案]请你帮助小红完成实验报告
实验方法 | 观察到的现象 | 实验结论 |
把少量的“蓝色水”注入试管中,插入一根光亮的铁丝。 | 铁丝表面变成___ 色 | 溶质中含有铜离子 |
把少量的“蓝色水”注入试管中,滴入硝酸钡溶液和稀硝酸 | 白色沉淀 | 溶质中含有的阴离子是__________。 |
[结论与应用]“蓝色水”中溶质的化学式是__________。该物质可以做过氧化氢溶液制氧气反应催化剂,写出此反应的化学方程式_____________________________。
【答案】CuSO4 红 硫酸根离子 CuSO4 2H2O2 ![]() 2H2O + O2↑
2H2O + O2↑
【解析】
[提出问题]“蓝色水”中的溶质是什么?
[猜想]小红经过查阅资料和自己学过的化学知识,她猜溶质可能是CuSO4 。[查阅资料]含有铜离子的溶液一般呈蓝色。碳酸钡、硫酸钡都是白色沉淀,硫酸钡还不溶于稀硝酸。[设计方案]
实验方法 | 观察到的现象 | 实验结论 |
把少量的“蓝色水”注入试管中,插入一根光亮的铁丝。 | 铁丝表面变成红色 | 溶质中含有铜离子 |
把少量的“蓝色水”注入试管中,滴入硝酸钡溶液和稀硝酸 | 白色沉淀 | 溶质中含有的阴离子是硫酸根离子。 |
[结论与应用]“蓝色水”中溶质的化学式是CuSO4。该物质可以做过氧化氢溶液制氧气反应催化剂,此反应的化学方程式是2H2O2 ![]() 2H2O + O2↑。
2H2O + O2↑。
点睛∶本题主要考查硫酸铜的性质。


科目:初中化学 来源: 题型:
【题目】变压吸附法的原理是利用分子筛吸附氮气和氧气能力的差异将二者进行分离。在吸附塔中,通过加压与减压的交替循环,可以使分子筛重复使用,部分过程的示意图如下。
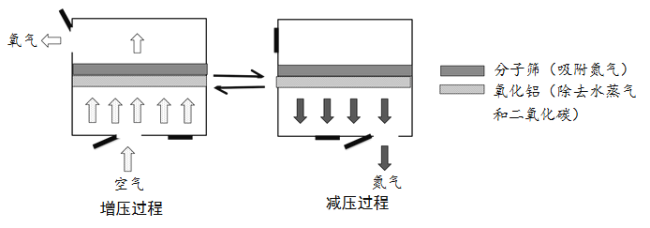
(1)分子筛中发生的变化是 (填“物理变化”或者“化学变化”)。
(2)下列说法正确的是 (填序号)。
A.变压吸附法制取的氧气中含有稀有气体
B.变压吸附法制取的氧气中含有二氧化碳
C.分子筛对氮气的吸附能力与吸附塔内气体压强有关
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下充分发生化学反应,测得反应前后各物质的质量变化如图。下列说法中错误的是 ( )
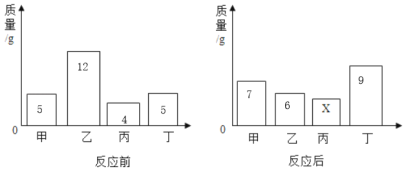
A. 丙可能为该反应的催化剂 B. 该反应中丁、乙质量变化之比为2:3
C. 反应后图中的X=4 D. 该反应为化合反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】用化学用语填空。
(1)核内没有中子的原子________;(2)2个氯气分子________;(3)5个铝原子________;
(4)3个氧离子_____________; (5)人体中含量最多的金属元素________;
(6)下图表示在催化剂条件下,某化学反应的微观模拟示意图,请写出该反应的符号表达式____
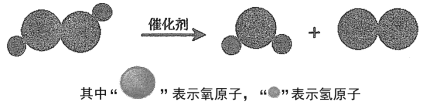
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在学习碳酸钠的性质时,做过“向盛有少量碳酸钠溶液的试管里滴入澄清的石灰水”的实验,发现没有看见白色沉淀的现象。经分析,可能是石灰水变质了,变质的原因是(用化学方程式表示)_____________________________。用实验来证明石灰水完全变质,所用的试剂是________,产生的现象是______________________________。若不考虑用错药品,还有可能导致没有看见白色沉淀的现象的原因____________________________。(此空2分)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有关物质组成及化学规律的发现对化学的发展做出了重要贡献。
(1)法国化学家拉瓦锡为化学学科的发展做出了巨大贡献,下列有关发现与他有密切关系的是_____。
A. 空气的组成 B. 质量守恒定律 C. 水的组成 D. 酸碱指示剂
(2)在密闭容器内加入下列两种物质,并称量加入前后的总质量(含密闭容器),能验证质量守恒定律的是_____________(填标号)。
A. 蔗糖和水 B. 氯化钠溶液和硝酸钾溶液 C. 氯化钡溶液和稀硫酸
(3)在氧气中点燃红磷的实验过程,固体质量变化如图所示。
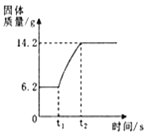
①从燃烧条件分析,固体质量在t1前没有发生变化的原因是___________。
②该反应的化学方程式为________________。
③参加反应的氧气质量为___________g。
(4)某学习小组拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。
查阅资料可知Mg、Mg3N2能发生如下反应:
①2Mg+O2 △ 2MgO; ②3Mg+N2 △ Mg3N2; ③2Mg+CO2 △ 2MgO+C
④Mg+H2O △ MgO+H2↑ ⑤Mg3N2+6H2O 3Mg(OH)2↓+2NH3↑
实验中所用的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。回答下列问题:
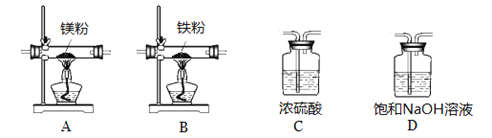
①连接并检查实验装置的气密性,实验开始时,将空气通入实验装置,则气流流经装置的顺序是______(填装置序号)。D装置中发生反应的化学方程式为___________。
②通气后,如果同时点燃A、B装置的酒精灯,对实验结果有何影响?_________。
③设计一个实验,验证产物是否含氮化镁:
实验操作和实验现象 | 实验结论 |
________________________ | 产物中含有氮化镁 |
④思维拓展:空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO的质量却远大于Mg3N的质量,请给出合理的解释_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上合成NH3的工艺流程可简化为:
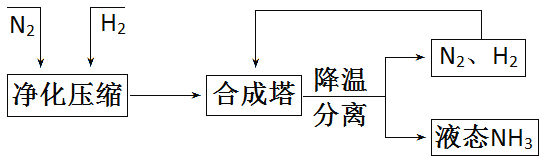
(1)工业上制取N2时所用的廉价、易得的原料是_____________;
(2)用焦炭和水蒸气制取氢气的反应过程为:![]() ,该反应的还原剂是_________;
,该反应的还原剂是_________;
(3)合成塔中在高温、高压、催化剂的条件下生成NH3的化学方程式为__________________;
(4)将降温分离出的N2、H2送回合成塔的目的是_______。
A.充分利用原料 B.防止氮气污染空气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某小组同学在用过氧化氢溶液与MnO2制取氧气的过程中,发现反应的速度很慢,产生的气泡很少。为此,他们进行了如下探究。
(猜想与假设)
①速度慢、气泡少可能与过氧化氢溶液的浓度有关。
②速度慢、气泡少可能与MnO2的质量有关。
(进行实验)根据下图进行如下实验。
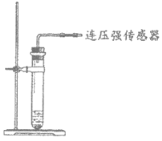
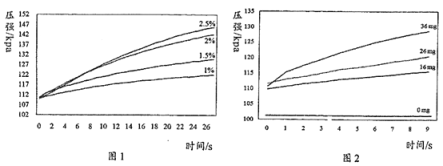
实验1:用26 mg MnO2与5 mL不同浓度过氧化氢溶液进行实验,压强变化如图1。
实验2:用5 mL 1.5%过氧化氢溶液与不同质量MnO2进行实验,压强变化如图2。
(解释与结论)
(1)实验1得到的结论是______________________________。
(2)实验2的目的是________________________________。
(3)小组同学在制氧气过程中,发现反应的速度很慢,依据上述实验所得结论,推测其原因可能是_____________。
(反思与评价)
(4)利用上图装置探究“温度对过氧化氢分解速率”的影响,是否合理?理由是_____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】空气中有氧气,利用分离液态空气的方法得到氧气是工业上制取氧气的重要途径,如图所示是工业上制氧气流程图:
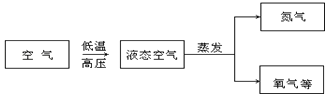
(1)氮气的沸点﹣196℃,氧气的沸点﹣183℃,在蒸发的过程中_____(填“氮气”或“氧气”)先被蒸发出来。这样制得的氧气是_____(填“纯净物”或“混合物”)。
(2)从微粒的角度分析,空气液化的原因是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com