
分析 (1)食品、药品、营养品、矿泉水等物质中的“硒”等不是以单质、分子、原子等形式存在,而是指元素,通常用元素及其所占质量(质量分数)来描述.
(2)根据题意,避免食物因发生缓慢氧化而变质,进行分析解答.
(3)根据在化合物中正负化合价代数和为零,生活中自来水降低硬度的方法,进行分析解答.
(4)根据出土文物中铁制品比铜制品生锈严重,结合金属活动性顺序进行分析解答.
(5)根据融雪剂除雪的原理是溶于水后使凝固点降低,进行分析解答.
解答 解:(1)我省在唐山、保定、石家庄等地发现了大面积的富硒“抗癌”地带,这里的硒不是以单质、分子、原子等形式存在,这里所指的“硒”是强调存在的元素,与具体形态无关.
(2)为了避免食物因发生缓慢氧化而变质,往往采用真空包装的方法,真空包装的目的是除去空气,使食品与氧气隔绝,使大多数微生物因缺少氧气受到抑制,停止繁殖,同时防止食品发生缓慢氧化而变质.
(3)钠元素显+1价,氧元素显-2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6价.
煮沸能降低水的硬度,生活中自来水还需经过煮沸后才能饮用.
(4)出土文物中铁制品比铜制品生锈严重,是因为铁的金属活动性比铜强,更易锈蚀.
(5)在公路上撒融雪剂,主要是利用了物质溶解后溶液的凝固点降低,从而加快雪的溶解,可用作消除积雪的融雪剂.
故答案为:(1)元素;(2)真空包装;(3)+6;煮沸;(4)铁的金属活动性比铜强;(5)凝固点降低.
点评 本题难度不大,掌握金属锈蚀的原理、化合物中正负化合价代数和为零、融雪剂融雪的原理等并能灵活运用是正确解答本题的关键.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:初中化学 来源: 题型:选择题
| A. | 铝的金属活动性比铁强,则铝制品比铁制品更容易锈蚀 | |
| B. | 水和过氧化氢的组成元素相同,则两者的化学性质相同 | |
| C. | 化合物由不同种元素组成,则只含有一种元素的物质一定不是化合物 | |
| D. | 洗洁精清洗油污利用了乳化作用,则汽油清洗油污也是利用了乳化作用 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
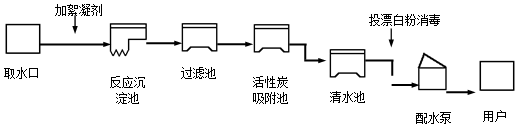
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
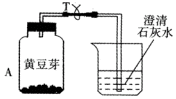 小明为了探究植物也能呼吸,做了以下实验:把装有吸干外表水的黄豆芽的塑料瓶A放在暗处24小时;导管T处用夹子夹住,不让外界空气进入;24小时后,观察塑料瓶壁;把T处夹子打开,用力压A瓶,让瓶内气体通入到右侧烧杯内,发现澄清石灰水变浑浊,塑料瓶内壁有水珠,用温度 计测量豆芽温度,可发现温度升高.
小明为了探究植物也能呼吸,做了以下实验:把装有吸干外表水的黄豆芽的塑料瓶A放在暗处24小时;导管T处用夹子夹住,不让外界空气进入;24小时后,观察塑料瓶壁;把T处夹子打开,用力压A瓶,让瓶内气体通入到右侧烧杯内,发现澄清石灰水变浑浊,塑料瓶内壁有水珠,用温度 计测量豆芽温度,可发现温度升高.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | b-a=d-c | B. | a+n=c-m | C. | a-n=c+m | D. | b-n=d+m |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
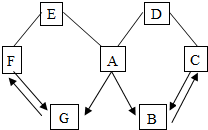 如图所示A~G是初中科学中常见的物质.图中“→”表示转化关系,“-”表示相互能反应.已知A是人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物.请回答:
如图所示A~G是初中科学中常见的物质.图中“→”表示转化关系,“-”表示相互能反应.已知A是人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物.请回答:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$ 2H2O+O2↑ | B. | 2CuO+C$\frac{\underline{\;高温\;}}{\;}$2Cu+CO2 | ||
| C. | Fe3O4+4CO$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | D. | BaCl2+H2SO4═BaSO4↓+2HCl |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
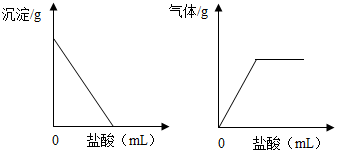 有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )
有一包白色固体,可能含有Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种.取样溶于水,有白色沉淀产生;过滤后向沉淀中滴加盐酸,沉淀的量、产生气体的量与加入盐酸体积的关系如图所示.由此推断白色固体中( )| A. | 肯定只存在Na2CO3 | B. | 肯定不存在BaCl2 | ||
| C. | 可能存在Na2SO4 | D. | 可能存在NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com