
【题目】硫酸铜和硫酸的混合溶液中硫元素的质量分数占3.2%,现将100g该混合溶液加入到氢氧化钠溶液中,恰好完全反应,测得消耗氢氧化钠溶液的质量为100g。下列说法不正确的是( )
A. 生成氢氧化铜沉淀的质量为9.8g
B. 氢氧化钠溶液中钠元素质量为4.6g
C. 所得溶液中溶质的质量为14.2g
D. 氢氧化钠溶液中溶质的质量分数为8%
科目:初中化学 来源: 题型:
【题目】某补钙药剂的标签主要内容如图所示,现测定该钙片含量是否符合标注,做如下实验:取10片该钙片,放入干燥、洁净的烧杯中,再向烧杯中加入50g某浓度稀盐酸,恰好完全反应(钙片中其他成分不溶于水,也不和稀
盐酸反应,反应中产生的气体全部放出),反应后称量烧杯内剩余物质的质量为64.5g.

(1)反应中生成二氧化碳质量;______
(2)通过计算说明每片钙片实际钙含量。说明是否与标注相符?______
(3)试计算所用稀盐酸的溶质质量分数.______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】泉城”济南,素有“四面荷花三面柳,一城山色半城湖”的美誉。2019 年济南仍将坚决打好蓝天碧水保卫战,力争将济南打造成集山、泉、湖、河、城为一体的“城市绿心”。为了解小清 河的治理状况,某化学兴趣小组的同学进行了实验探究。

①兴趣小组的同学从小清河中取水样,过滤,将少量澄清滤液滴在洁净的玻璃片上,置于酒精灯上加热,水分蒸干后,观察到玻璃片上有少许白色的固体残留,其原因是_____。
②为检测小清河水质情况,兴趣小组的同学需要用pH试纸检测该水样的酸碱度,正确的操作方法是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请用化学用语填空:
(1)氩的元素符号_____。
(2)两个亚铁离子_____。
(3)标出碳酸钾中碳元素的化合价_____。
(4)地壳中含量最多的元素_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】废铁屑主要成分是铁,还有少量铁锈(Fe2O3),硫酸亚铁的生产工艺如图所示。

(1)在反应器中除发生Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Fe2(SO4)3+Fe═3FeSO4这两个反应外,还会发生另外一个反应,化学方程式为:_____,反应器要加强通风,严禁烟火,其原因是:_____。
(2)将成品在有氧条件下焙烧,可转化为Fe2O3、SO2和SO3.为了提高SO3的产率,某实验小组进行了系列探究,实验数据如下:
编号 | 空气通入量/Ls﹣1 | 温度/℃ | SO2产率% | SO3产率/% |
a | 0.02 | 850 | 45.4 | 54.6 |
b | 0.06 | 850 | 30.5 | 69.5 |
c | 0.10 | 810 | 11.1 | 88.9 |
d | 0.10 | 850 | 11.1 | 88.9 |
e | 0.10 | 890 | 11.2 | 88.8 |
①本实验主要研究了哪些因素对SO3产率的影响_____。
②根据上表数据,生产过程中采用实验_____(填编号)的提取条件最合理。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有如图所示装置,回答下列问题。

(1)填写仪器名称:Y_____;X_____。
(2)检查装置A气密性的操作和现象是:先_____,向X中加水至形成一段水柱,静置,观察到水柱高度不变,说明气密性良好。
(3)B是制取蒸馏水的简易装置。烧杯中冷水的作用是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化钙(CaO2)难溶于水,常温下稳定,在潮湿空气及水中缓慢放出氧气,广泛应用于渔业等领域,特别是鱼苗在长途运输中,通常将鱼苗养在相对密闭的容器内,在容器内满足下列条件才能保持鱼存活:充足的氧气;及时除去鱼呼出的CO2,容器中的水要呈弱碱性。加入过氧化钙后,就可以解决这些问题。
(1)过氧化钙(CaO2)中的氧元素的化合价为_____。
(2)过氧化钙的供氧原理是过氧化钙可以与水反应生成氧气和氢氧化钙,请写出过氧化钙与水反应的化学方程式_____。
(3)小明想在实验室用过氧化钙固体与水反应制取氧气。实验过程中发现过氧化钙与水反应“开始有较多细小气泡放出,随后放出气泡的速咸缓”,原因可能是_____。
(4)如图是以大理石(含A12O3及其他不溶于水也不溶于酸的杂质)等为原料制取CaO2的流程图
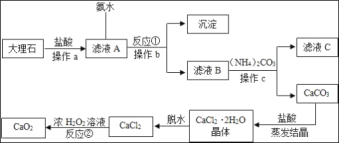
①操作a、b、c的名称都为_____。
②从滤液C中可回收的副产品的化学式为_____,属于_____肥。
③写出反应①的化学方程式_____。
④反应②是在低温下往过氧化氢浓溶液中投入无水氯化钙进行反应,该反应的化学方程式为_____,基本反类型是_____。
⑤在该生产过程中,用110kg的大理石制得了72kg的过氧化钙,如果不考虑过程中的损耗可计算出大理石中CaCO3的质量分数为_____(结果保留一位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸锂作为锂的基础锂盐,广泛用于玻璃制造和陶瓷生产过程中的添加剂,也是制备锂电池的重要原料。碳酸锂在热水中的溶解度很小,工业上以锂辉石精矿(主要成分是Li2O、含有Al2O3、SiO2等杂质)为原料制取碳酸锂的硫酸法生产工艺流程如下
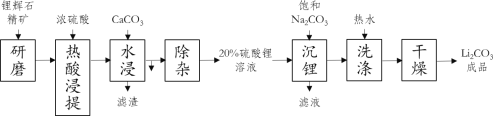
(1)锂辉石热酸浸提前要进行“研磨”,其目的是_____
(2)“水浸”中加入CaCO3的作用之一是为了调节pH=5,让溶液中的Al3+变成Al(OH)3沉淀出来,要确定溶液的pH值为5,可以用pH试纸来测定,其操作方法是_____
(3)“沉锂”中加入的Na2CO3溶液是饱和溶液,其作用是_____,反应的化学方程式为_____
(4)“洗涤”中使用热水,原因是_____,证明洗涤干净的方法是_____
(5)为了探究热酸浸提的最佳条件,将矿石在一定条件下酸浸4小时,锂元素浸出率的数据如下表
编号 | 矿酸比 | 硫酸浓度(%) | MgSO4用量(g) | 温度(℃) | 锂元素浸出率(%) |
1 | 1:1 | 90 | 0.00 | 100 | 70.34 |
2 | 1:1 | 98 | 0.00 | 100 | 73.89 |
3 | 1:1 | 98 | 0.00 | 150 | 78.24 |
4 | 1:3 | 98 | 0.00 | 200 | 85.53 |
5 | 1:3 | 98 | 1.25 | 250 | 90.26 |
6 | 1:3 | 98 | 2.50 | 250 | 95.88 |
①本实验中,编号为_____两组实验能说明温度对锂元素浸出率的影响
②根据上表数据,MgSO4用量对锂元素浸出率的影响是_____
③在工业生产过程中,相当数量的硫酸和纯碱变成了价值较低的Na2SO4等物质,从而造成了生产成本的提高,为了降低生产成本,除了尽可能减少硫酸的配量外,降低能源消耗也是一个方面,因此,可以继续设计实验,以探究出最佳锂元素浸提工艺条件,下列设计合理的是_____(填字母)
A 矿酸比1:2,硫酸浓度98,MgSO4用量0.00,温度150℃
B 矿酸比1:2,硫酸浓度98,MgSO4用量1.25,温度200℃
C 矿酸比1:2,硫酸浓度98,MgSO4用量2.50,温度200℃
D 矿酸比1:2,硫酸浓度98,MgSO4用量2.50,温度250℃
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如下图所示。回答下列问题:
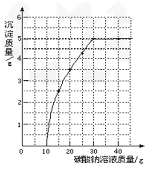
(1)从图中看出生成沉淀的最大质量是_____g。
(2)开始加入碳酸钠溶液至10g时,还没有沉淀的原因是____。
(3)计算原滤液中氯化钙的质量分数_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com