
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | 饱和溶液就是不能再继续溶解溶质的溶液 | |
| B. | 同一溶质的饱和溶液一定比其不饱和溶液浓 | |
| C. | 热的饱和溶液降低温度时,一定会析出晶体 | |
| D. | 与溶质固体共存的溶液一定是饱和溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
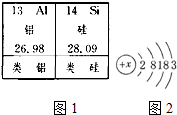 阅读材料,回答问题.
阅读材料,回答问题.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 红磷在氧气中燃烧时,放出大量的热,产生大量白烟 | |
| B. | 木炭在氧气中燃烧时,发出耀眼白光,生成一种无色有刺激性气味的气体 | |
| C. | 铁丝在氧气中剧烈燃烧时,火星四射,放出大量的热,生成黑色固体 | |
| D. | 硫粉在氧气中燃烧时,发出蓝紫色火焰,放出大量的热,闻到刺激性气味 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
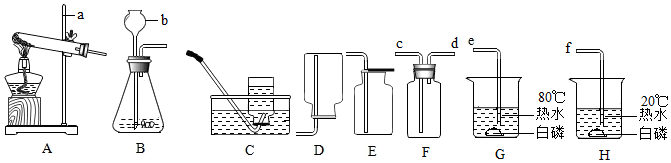
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com