
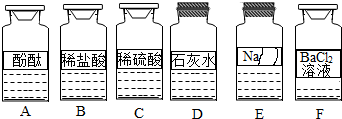
| 实验方案 | 实验一 | 实验二 | 实验三 |
| 实验操作 | 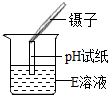 | 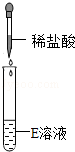 | 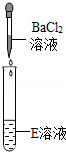 |
| 实验现象 | 试纸变色,对照比色卡,pH>7 | 有无色无味气体产生 | 有白色沉淀产生 |
| 实验结论 | 猜想Ⅱ正确 | ||
分析 【初步判断】根据实验室药品分类摆放的原则,利用对各类物质的组成特点的认识,猜想该药品的物质类别;
【设计并实验】根据碳酸钠和氯化钡反应的原理分析现象;
【分析与推理】①根据氢氧化钠和碳酸钠溶液性质进行分析;
②碳酸钠和氯化钡反应产生碳酸钡沉淀和氯化钠;
【反思与评价】根据测定该溶液酸碱度的操作方法指出错误;
从大理石(主要成分是CaCO3)和稀盐酸(主要成分HCl),二者接触即可发生反应生成氯化钙、水和二氧化碳.反应不需要加热,二氧化碳气体的密度比空气大、能溶于水去分析解答.
解答 解:【初步判断】根据实验室药品分类摆放的原则分析可知该药品是按照酸碱盐顺序摆放的,由于该试剂瓶左侧是碱类物质右侧是盐类物质,所以该物质的类别应该是碱或者盐类物质,因此可猜断该物质不可能为酸;
故答案为:①;
【设计并实验】碳酸钠和氯化钡反应产生碳酸钡白色沉淀和氯化钠,因此会产生的现象为:有白色沉淀产生;
故答案为:有白色沉淀产生;
【分析与推理】①由于氢氧化钠和碳酸钠溶液都显碱性,因此测得的pH>7,故无法判断是哪一种物质;
②碳酸钠和氯化钡反应产生碳酸钡沉淀和氯化钠,反应的方程式为:Na2CO3+BaCl2=2NaCl+BaCO3↓;
故答案为:①碳酸钠和氢氧化钠溶液均显碱性;②Na2CO3+BaCl2=2NaCl+BaCO3↓;
【反思与评价】使用pH试纸测定溶液酸碱度时应该用玻璃棒蘸取待测液滴在试纸上,而不应该浸入待测液,否则会造成试剂的污染;
大理石(主要成分是CaCO3)和稀盐酸(主要成分HCl),二者接触即可发生反应生成氯化钙、水和二氧化碳.化学化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;由于实验室制二氧化碳的反应条件是不需要加热,故发生装置为B,二氧化碳气体的密度比空气大、能溶于水,故只能用向上排空气法而不能用排水法,故收集装置为C.
故答案为:①把pH试纸浸入待测液;②B;C;CaCO3+2HCl═CaCl2+H2O+CO2↑.
点评 本题是缺失标签的实验探究题,相当于物质鉴别题,在鉴别几种物质时要从物质的不同性质入手,但试题涉及知识点多,要加强知识的全面性和系统性.特别注意检验溶液是否是氢氧化钠溶液,就需要排除碳酸钠对氢氧化钠的鉴定干扰,加入足量的氯化钙溶液可使碳酸根转化成沉淀,而后对溶液用酚酞试液进行检验,只要溶液此时变红,则可证明氢氧化钠的存在.


科目:初中化学 来源: 题型:选择题
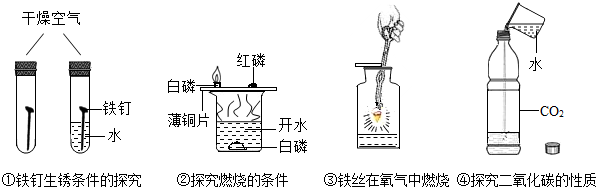
| A. | 实验①中的水:使铁生锈的条件之一 | B. | 实验②中的水:只为了提供能量 | ||
| C. | 实验③中的水:防止集气瓶炸裂 | D. | 实验④中的水:作反应物 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
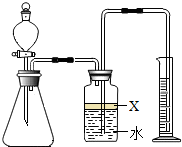 氮化铝(AlN)是一种新型材料.某氮化铝样品中含有碳或氧化铝杂质,已知氮化铝和NaOH溶液能反应,其反应方程式为①AlN+NaOH+H2O=NaAlO2+NH3↑②氧化铝也能与氢氧化钠溶液反应而全部溶解,但不生成气体.现用如图所示中的一些装置来进行相关实验.根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计).
氮化铝(AlN)是一种新型材料.某氮化铝样品中含有碳或氧化铝杂质,已知氮化铝和NaOH溶液能反应,其反应方程式为①AlN+NaOH+H2O=NaAlO2+NH3↑②氧化铝也能与氢氧化钠溶液反应而全部溶解,但不生成气体.现用如图所示中的一些装置来进行相关实验.根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数,并根据实验现象来确定杂质的成分(实验中导管体积忽略不计).查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 无数雨滴从空中落下 | |
| B. | 金属导线导电 | |
| C. | 扫地时,看到空中飞舞的尘埃 | |
| D. | 香水瓶打开后,过一会屋内闻到香味 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 给试管里的液体加热时,不可让试管口对着自己和旁人 | |
| B. | 将电冰箱的金属外壳接地 | |
| C. | 制取氧气验满时,将带火星的木条放在集气瓶口 | |
| D. | 某人看到水库中的水不是很深,当旁边却竖着“水深危险”的牌子 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
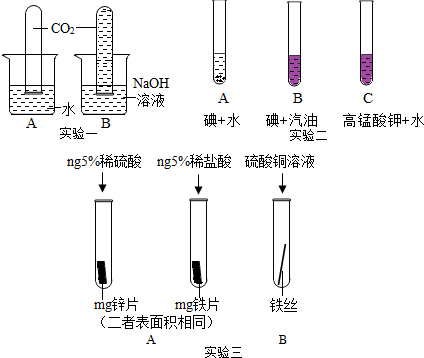
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com