解:(1)三种金属被发现使用的先后顺序铜、铁、铝,而三种金属活动性强弱顺序为铝>铁>铜,可见,金属大规模被使用的先后顺序跟金属的活动性有关;
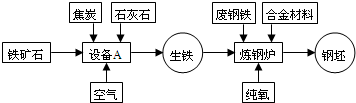
(2)根据化学方程式书写的步骤:写配注等,赤铁矿与一氧化碳在高温下反应制取铁的化学方程式为:
3CO+Fe
2O
3
2Fe+3CO
2;
(3)工业炼铁需要高温,燃料在纯氧中燃烧比在空气中燃烧更剧烈,放出的热量更多;
(4)根据金属锈蚀的条件及除锈的方法可知反应现象为:红色固体逐渐溶解,溶液由无色变为黄色,螺丝钉表面有气泡产生,反应方程式为:3H
2SO
4+Fe
2O
3═Fe
2(SO
4)
3+3H
2O;
(5)根据金属锈蚀的条件及其防护措施可知:去锈后在机械设备上涂油;
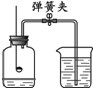
(6)铁与稀盐酸反应产生无色气体,但氧化钙与稀盐酸反应无明显现象,2HCl+Fe═FeCl
2+H
2↑;
故答案为:(1)③;
(2)3CO+Fe
2O
3
2Fe+3CO
2;
(3)促使反应更加剧烈,并获得更多的热量;
(4)红色固体逐渐溶解,溶液由无色变为黄色,螺丝钉表面有气泡产生;3H
2SO
4+Fe
2O
3═Fe
2(SO
4)
3+3H
2O;
(5)去锈后在机械设备上涂油;
(6)铁与稀盐酸反应产生无色气体,但氧化钙与稀盐酸反应无明显现象,2HCl+Fe═FeCl
2+H
2↑.
分析:(1)对比铜、铁、铝三种金属被发现使用的先后顺序与金属活动性关系,对影响金属大规模被使用的先后顺序的因素进行判断;
(2)根据化学方程式书写的步骤:写配注等,写出反应方程式;
(3)根据氧气具有助燃性,氧气浓度越大,燃烧越剧烈;进行解答;
(4)(5)根据金属锈蚀的条件及除锈的方法和其防护措施,进行解答;
(6)铁粉因生锈时需要有水参加,故可以做干燥剂;生石灰可与水反应生成熟石灰,因此也可做干燥剂.根据这两种物质的性质不同,可将其区分开.如加水,溶于水的是生石灰,不溶的是铁粉;也可加入稀盐酸,有气泡产生的为铁粉,否则为生石灰.
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

 2Fe+3CO2;
2Fe+3CO2; 2Fe+3CO2;
2Fe+3CO2;

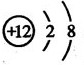 下列说法不正确的是
下列说法不正确的是