
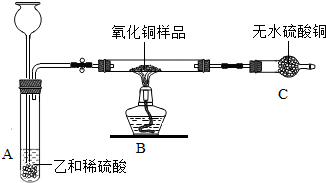
| 实验现象 | 化学方程式 |
| A中反应产生大量气泡; | A中:______. |
| B中黑色粉末逐渐变红色; | B中:CuO+H2 Cu+H20 Cu+H20 |
| C中白色粉末逐渐变蓝色. | C中;CuS04+5H20═CuS04?5H20 |
| 反 应 前 | 氧化铜完全反应后 | |
| ①组 | B:玻璃管的质量30.8克 氧化铜样品的质量5.0克 | B:玻璃管和管内固体物质的质量35.0克、 |
| ②组 | C:干燥管和硫酸铜的质量40.O克 | C:干燥管和管内固体物质的 质量41.0克 |
 Cu+H20
Cu+H20
 ×100%=80%;
×100%=80%;

 期末集结号系列答案
期末集结号系列答案科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
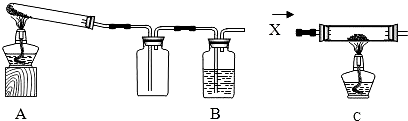
| 装置 | 反应前 | 反应后 |
| A | 试管的质量38.2 克 氧化铜和炭粉混合物的质量20.0克 |
试管和固体物质的质量56.8 克 |
| B | 反应后瓶内石灰水比反应前增重1.1 克 | |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?海珠区一模)某课外活动小组的同学为测定一瓶BaCl2溶液溶质的质量分数,做了以下实验,请回答有关问题:
(2012?海珠区一模)某课外活动小组的同学为测定一瓶BaCl2溶液溶质的质量分数,做了以下实验,请回答有关问题:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com