


科目:初中化学 来源: 题型:
| A、利用化学生产化肥和农药,以增加粮食的产量 |
| B、利用化学合成药物,以抑制细菌和病毒,保障人体健康 |
| C、利用化学开发新能源和新材料,以改善人类的生存条件 |
| D、化石燃料的直接利用,促进了低碳经济的发展 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、CO2气体(H2O)→固体氢氧化钠 |
| B、KNO3溶液(NaCl)→降温结晶 |
| C、C (CuO)→稀硫酸 |
| D、CO气体(CO2)→氢氧化钠溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、7.4g | B、11.1g |
| C、3.7g | D、14.8g |
查看答案和解析>>
科目:初中化学 来源: 题型:
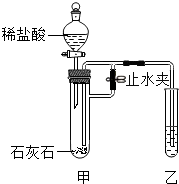 某化学小组在课外活动时利用如图装置进行实验 (图中铁架台等仪器已略去).
某化学小组在课外活动时利用如图装置进行实验 (图中铁架台等仪器已略去).查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
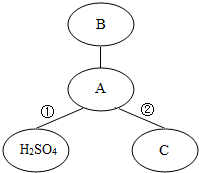 如图中,相连的两种物质间能发生化学反应.请回答有关的问题:
如图中,相连的两种物质间能发生化学反应.请回答有关的问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com