
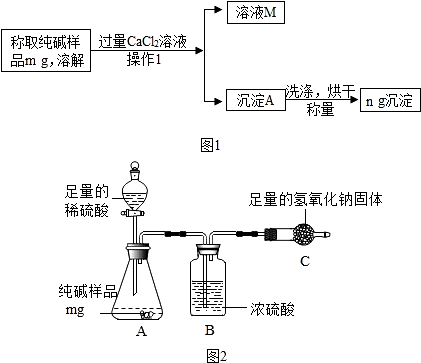
分析 方案一:(1)操作1中加入过量氯化钙的目的是把碳酸钠充分反应,然后经过过滤操作把固体和液体分离;
(2)样品中的氯化钠和氯化钙不反应,由于氯化钙过量,因此碳酸钠完全反应,且生成了氯化钠,因此溶液M中含有的阳离子有钠离子和钙离子;
(3)氯化钙能与碳酸钠反应生成碳酸钙沉淀;
(4)根据化学方程式进行分析计算;
(5)若沉淀A没有洗涤烘干,会导致计算出的碳酸钠质量偏大;若沉淀A洗净不干净,则所得滤液中含有银离子,可通过滴加AgNO3溶液观察是否有沉淀的方法判断;
方案二:
(1)根据化学方程式的书写和仪器的名称进行分析.
(2)根据浓硫酸的吸水性和化学方程式的书写方法进行分析.
(3)通过称量C装置在反应前后的质量,即可求得产生二氧化碳的质量.
(4)【方法二】中装置内的残留二氧化碳没有被吸收,空气中的二氧化碳和水蒸气也会进入C装置.
解答 解:方案一:
(1)“操作Ⅰ”的名称是过滤.
故答案为:过滤;
(2)样品中的氯化钠和氯化钙不反应,由于氯化钙过量,因此碳酸钠完全反应,且生成了氯化钠,因此溶液M中含有的阳离子有钠离子和钙离子.
故答案为:钠离子和钙离子;
(3)若氯化钙有剩余,加入碳酸钠溶液会生成碳酸钙白色沉淀,若氯化钙没有剩余,加入碳酸钠溶液无明显变化,故填:B;
(4)解:设样品中碳酸钠的质量为x,则
Na2CO3+CaCl2=2NaCl+CaCO3↓
106 100
x 10g
$\frac{106}{100}=\frac{x}{10g}$
x=10.6g
样品中Na2CO3质量分数为$\frac{10.6g}{12g}×100%$≈88.3%
答:样品中Na2CO3质量分数为88.3%;
(5)若沉淀A没有洗涤烘干,会导致计算出的碳酸钠质量偏大,碳酸钠的质量分数就偏大;判断沉淀A洗净的方法是:取最后一次洗涤所得滤液,滴加AgNO3溶液,若无白色沉淀,则洗涤干净.
故答案为:偏大;无;
方案二:
(1)碳酸钠和稀硫酸反应的化学方程式为Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,盛稀硫酸的仪器名称为分液漏斗.
故答案为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;分液漏斗;
(2)浓硫酸具有吸水性,因此B装置的作用是除去水蒸气;二氧化碳和氢氧化钠反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
故填:除去水蒸气;CO2+2NaOH=Na2CO3+H2O;
(3)C装置在反应前后的质量差,即是产生二氧化碳的质量.
故答案为:C;
(4))【方法二】中装置内的残留二氧化碳没有被吸收,空气中的二氧化碳和水蒸气也会进入C装置.
故答案为:装置内的残留二氧化碳没有被吸收,空气中的二氧化碳和水蒸气也会进入C装置.
点评 本题难度太大,考查了多方面的化学知识,要想做对此题必须知识全面,再加上足够的细心和耐心才行.


 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:初中化学 来源: 题型:选择题
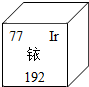 今年央视3.15晚会揭开周大生等品牌黄金制品掺杂铱牟取暴利的内幕.铱元素在周期表中的信息如图所示.下列说法不正确的是( )
今年央视3.15晚会揭开周大生等品牌黄金制品掺杂铱牟取暴利的内幕.铱元素在周期表中的信息如图所示.下列说法不正确的是( )| A. | 铱属于金属元素 | B. | 铱的原子序数是77 | ||
| C. | 铱原子的核外电子数为77 | D. | 铱原子相对原子质量是192g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | La+HCl | B. | La2O3+HCl | C. | NaCl+La(NO3)3 | D. | La(OH)3+HCl |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 甲醇为无机物 | |
| B. | 甲醇由碳原子、氧原子、氢原子构成 | |
| C. | 甲醇中碳元素与氢元素的质量比为1:4 | |
| D. | 该合成过程CO和H2的质量比为7:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 ”和“
”和“ ”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下:
”分别代表两种不同的单质分子A2和B2,它们在一定条件下能发生化学反应,其反应的微观示意图如下: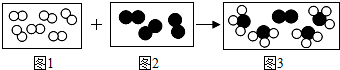
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com