考点:物质的相互转化和制备,物质除杂或净化的探究,二氧化碳的化学性质,一氧化碳的化学性质,盐的化学性质,碳的化学性质,书写化学方程式、文字表达式、电离方程式
专题:物质的制备,物质的分离、除杂、提纯与共存问题
分析:(1)根据反应物和产物书写化学方程式;
(2)根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答:解:(1)①碳与氧化铜在高温下反应生成铜和二氧化碳,化学方程式为:C+2CuO
2Cu+CO
2;
②在氧气不足时,碳与氧气反应生成一氧化碳,化学方程式为:2C+O
2(不足)
2CO;
③碳与二氧化碳在高温下反应生成一氧化碳,化学方程式为:CO
2+C
2CO;
④一氧化碳在氧气中燃烧生成二氧化碳,化学方程式为:2CO+O2
2CO
2;
(2)①CO
2能与氢氧化钠溶液反应生成碳酸钠和水,CO不与氢氧化钠溶液反应,能除去杂质且没有引入新的杂质,符合除杂原则;反应的化学方程式为:CO
2+2NaOH═Na
2CO
3+H
2O;
②依据氯酸钾加热会分解生成氯化钾和氧气,而氯化钾不能,所以可采用加热的方法除掉氯酸钾(不要放二氧化锰),反应的化学方程式为:2KClO
32KCl+3O
2↑;
③碳酸钙在高温下分解生成氧化钙和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则;反应的化学方程式为:CaCO
3CaO+CO
2↑;
④一氧化碳具有还原性,能与灼热的氧化铜反应生成铜和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则;反应的化学方程式为:CO+CuO
Cu+CO
2.
故答案为:(1)①C+2CuO
2Cu+CO
2;
②2C+O
2(不足)
2CO;
③CO
2+C
2CO;
④2CO+O2
2CO
2;
(2)①CO
2+2NaOH═Na
2CO
3+H
2O;
②2KClO
32KCl+3O
2↑;
③CaCO
3CaO+CO
2↑;
④CO+CuO
Cu+CO
2.
点评:物质的分离与除杂是中考的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.

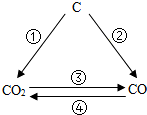 (1)写出下列转化的化学方程式(注:每种转化关系写一个方程式,方程式不得重复)
(1)写出下列转化的化学方程式(注:每种转化关系写一个方程式,方程式不得重复)

 今年日本福岛发生大地震,核电站发生核泄漏.我国多地发生辐射物,造成恐慌,人们排队抢购碘盐以防辐射.如图是广东盐业公司生产的加碘盐部分标签.回答
今年日本福岛发生大地震,核电站发生核泄漏.我国多地发生辐射物,造成恐慌,人们排队抢购碘盐以防辐射.如图是广东盐业公司生产的加碘盐部分标签.回答
 下列数据是硝酸钾固体在不同温度时的溶解度.
下列数据是硝酸钾固体在不同温度时的溶解度.