
 海水中蕴含着80多中元素,海洋是一座巨大的宝库.氯碱工业以海水为原材料可以大量制取烧碱和氯气,它们都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于工业生产.所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域.
海水中蕴含着80多中元素,海洋是一座巨大的宝库.氯碱工业以海水为原材料可以大量制取烧碱和氯气,它们都是重要的化工生产原料,可以进一步加工成多种化工产品,广泛用于工业生产.所以氯碱工业及相关产品几乎涉及国民经济及人民生活的各个领域.分析 (1)根据质量守恒定律分析A的化学式;
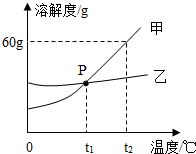
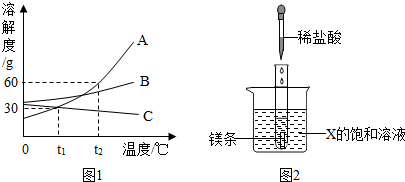
(2)①根据溶解度曲线交点的意义分析回答;
②根据甲、乙的溶解度随温度变化的情况分析分离提纯的方法;
③根据t2℃时,甲的溶解度的意义分析计算.
解答 解:(1)根据质量守恒定律和氯碱工业中发生反应的化学方程式为:2NaCl+2H2O=2NaOH+Cl2↑+A,反应前有;2Na、2Cl、4H、2O,反应后有:2Na、2H、2Cl、2O,故A中含有两个氢原子,故化学式为:H2;
(2)①P点是t1℃时甲、乙两物质的溶解度曲线的交点,表示的意义是:在t1℃时,甲、乙两物质的溶解度相等;
②从溶解度曲线可以看出:甲物质的溶解度随温度的降低而明显减小,而乙物质的溶解度随温度的降低变化不大,所以甲物质中含有少量乙物质,可采用降温结晶的方法提纯A物质;
③从溶解度曲线可以看出,t2℃时,甲的溶解度为60g,由此可知50g的水中只能溶解30g的甲物质,所以,将50g甲与50g水混合后所得的溶液为饱和溶液,则甲的饱和溶液中溶质的质量分数=$\frac{60g}{100g+60g}$×100%=37.5%.
故答案为:(1)H2;(2)①在t1℃,甲乙两物质溶解度相等;②降温结晶,甲物质的溶解度随温度的降低而明显减小,而乙物质的溶解度随温度的降低变化不大③37.5%.
点评 熟练掌握质量守恒定律及其应用;会读溶解度曲线,并利用它处理题目.


 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:解答题
 实验课上,甲同学用石蕊试液测定稀盐酸和NaOH溶液的酸碱性,乙同学用石蕊试液测定石灰水和Na2CO3溶液的酸碱性(如图所示).实验后进行废液处理:甲同学将两支试管中的液体倒入烧杯A中,得到蓝色溶液;乙同学将两支试管中的液体倒入烧杯B中,得到蓝色溶液和白色沉淀;最终将A中的溶液和B中的上层清液倒入烧杯C中.
实验课上,甲同学用石蕊试液测定稀盐酸和NaOH溶液的酸碱性,乙同学用石蕊试液测定石灰水和Na2CO3溶液的酸碱性(如图所示).实验后进行废液处理:甲同学将两支试管中的液体倒入烧杯A中,得到蓝色溶液;乙同学将两支试管中的液体倒入烧杯B中,得到蓝色溶液和白色沉淀;最终将A中的溶液和B中的上层清液倒入烧杯C中.| 操作方法 | 实验现象 | 实验结论 |
| ①取少量滤液于试管中,向其中滴加足量的稀盐酸 ②取少量滤液于试管中,向其中加入碳酸钠溶液 ③取两只试管,分别加入少量的滤液,分别滴加足量的稀盐酸和碳酸钠溶液 | 有气泡产生 有沉淀产生 以上两只试管均无现象 | 则C中的废液成分是NaOH、NaCl、Na2CO3 则C中的废液成分是NaOH、NaCl、Ca(OH)2 则C中的废液成分是NaOH、NaCl |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 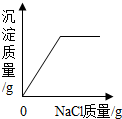 在一定量的AgNO3溶液中逐滴加入NaCl溶液 在一定量的AgNO3溶液中逐滴加入NaCl溶液 | |
| B. | 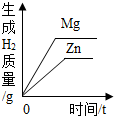 等质量的Zn和Mg分别与等体积等质量分数的稀硫酸(足量)反应 等质量的Zn和Mg分别与等体积等质量分数的稀硫酸(足量)反应 | |
| C. |  向NaOH溶液中逐滴加入稀盐酸 向NaOH溶液中逐滴加入稀盐酸 | |
| D. |  向NaOH和Na2CO3的混合溶液中,逐滴加入稀盐酸 向NaOH和Na2CO3的混合溶液中,逐滴加入稀盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 只有①③ | B. | 只有②④ | C. | 只有②③④ | D. | 只有①②④ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 江西不仅山清水秀、景色迷人,特色美食更是遍布各地令各路“吃货”流连忘返.
江西不仅山清水秀、景色迷人,特色美食更是遍布各地令各路“吃货”流连忘返.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com