
【题目】小刚为了解生活中常见的锌锰干电池,做了以下探究。
他打开一节废电池,观察到如下现象:①黑色碳棒完好无损;②电极周围充满黑色粉末;③里面有少量无色晶体;④金属外壳明显破损。
小刚查阅了资料:锌锰干电池的结构如图所示,它以中心的碳棒(石墨)作正极,外围的锌筒作负极,锌筒与碳棒之间填满用氯化铵溶液(作电解质)拌湿的二氧化锰和石墨,石墨不参加化学反应,仅起导电作用。在电池的使用中,锌逐渐变成了氯化锌。请你根据初中学习的知识和小刚的探究活动,完成下面各题: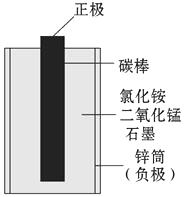
(1)用碳棒作电极主要利用了石墨的性。
(2)干电池在使用过程中的能量转化是。
(3)用简单的方法证明黑色粉末中含有石墨,写出操作步骤和实验现象:。
(4)通过回收废旧锌锰干电池可得到的物质有、(至少2种)。
【答案】
(1)导电
(2)化学能转化为电能
(3)将黑色粉末放在金属片上加热,黑色粉末能燃烧,在其上方放一块附有澄清石灰水的玻璃片,玻璃片上出现白色物质,则说明黑色粉末中含有石墨
(4)锌;二氧化锰(或碳棒、氯化锌等)
【解析】电池是一种将化学能转化为电能的装置,用碳棒作电极是由于石墨能导电,同时电池中还含有多种其他物质,如Zn、MnO2及生成的ZnCl2等,因此废旧电池不能随意丢弃,而应回收再利用。
所以答案是:导电;好想你转化成电能;将黑色粉末放在金属片上加热,黑色粉末能燃烧,在其上方放一块附有澄清石灰水的玻璃片,玻璃片上出现白色物质,则说明黑色粉末中含有石墨;锌;二氧化锰(或碳棒、氯化锌等)。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】在上化学探究课时,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
(1)【提出问题】黑色颗粒和白色物质是什么?
【进行猜想】甲认为黑色颗粒是碳(C),白色物质可能是Na2O或或 , 乙同学还认为白色物质是氢氧化钠。
甲同学立刻认为乙同学的猜想是错误的,其理由是。
(2)【查阅资料】氧化钠为白色粉末,溶于水生成氢氧化钠:Na2O+H2O=2NaOH
【实验探究】甲同学对白色物质进行实验探究。
实验方案 | 实验操作 | 实验现象 | 结论 |
方案1 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质 |
方案2 | ①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | 白色物质 |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
(3)【反思评价】丙同学认为方案1得到的结论不正确,其理由是。
(4)【得出结论】写出钠在二氧化碳中燃烧的化学方程式为。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对比法是学习化学的重要研究方法。下列实验方案设计中未采用对比法的是( )
A.探究燃烧的条件 
B.探究分子的性质 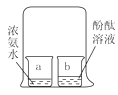
C.探究铁生锈的条件 
D.探究MnO2的催化作用 
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关实验现象的描述正确的是
A.细铁丝在氧气中剧烈燃烧,火星四射,生成Fe3O4黑色固体
B.打开盛有浓盐酸的试剂瓶,会观察到瓶口产生白色烟雾
C.将氨气通入无色酚酞溶液中,溶液变红
D.向氢氧化铜中滴加稀硫酸,生成无色溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列有关物质用途的说法错误的是
A.纯碱可用于制玻璃
B.氢氧化钠除油污是利用乳化的原理
C.熟石灰可用于改良酸性土壤
D.稀盐酸和稀硫酸均可用于除铁锈
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸亚铁是一种重要的食品和饲料添加剂,某补血剂样品【主要成分为硫酸亚铁晶体(FeSO4xH2O)】,某化学兴趣小组对其产生了兴趣并进行了探究:
【探究一】硫酸亚铁晶体(FeSO4xH2O)热分解研究
【查阅资料】
①无水硫酸铜粉末遇水会变成蓝色的硫酸铜晶体;
②硫酸亚铁晶体加热时,先失去结晶水,高温会继续分解产生金属氧化物和气态非金属氧化物。
③二氧化硫能使高锰酸钾溶液褪色。
【进行实验】该兴趣小组同学称取27.8g硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行分析,并利用SDTQ600热分析仪,对硫酸亚铁晶体热分解获得相关数据,绘制成图2所示的关系图,试回答:
(1)装置B中硫酸铜粉末变蓝,说明产物中有 , 该物质的质量是g;装置C中高锰酸钾溶液褪色,说明产物中还有;硫酸亚铁晶体完全分解后,装置A中的固体呈红棕色,放入足量稀盐酸,固体全部溶解,且得到黄色溶液,则该红棕色固体与稀盐酸反应的化学方程式为。
(2)D装置中球形干燥管的作用是。
(3)硫酸亚铁分解生成铁的氧化物和硫的两种氧化物,请写出化学反应方程式。
(4)根据图2中的数据,请求出FeSO4xH2O中的x=。(不写过程)
(5)【交流讨论】实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(6)【探究二】补血剂样品中硫酸亚铁的含量:
①取10g补血剂样品研细后溶于40g水中,研细的目的是;
②向所配制的溶液中加氯化钡溶液至略过量,使其充分反应;
③过滤,洗涤,干燥,称量所得白色固体的质量为6.99g。
请计算出10g样品中FeSO4的质量分数,写出计算过程。
(已知:FeSO4+BaCl2=BaSO4↓+FeCl2 , 有关相对分子质量:FeSO4—152,BaSO4—233)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com