
| A. | Ba2+、H+、CO32- | B. | H+、OH-、Na+ | C. | Ag+、Cl-、NO3- | D. | Cu2+、Fe2+、SO42- |
 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:解答题
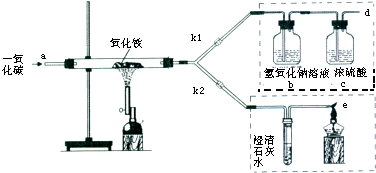
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 在公共场所有如右图广告,请回答下列问题:
在公共场所有如右图广告,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用汽油除去衣服上的油污 | B. | 用水洗去盘子中的水果渣 | ||
| C. | 用洗洁精清洗餐具上的油污 | D. | 用酒精除去衣服上的碘 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
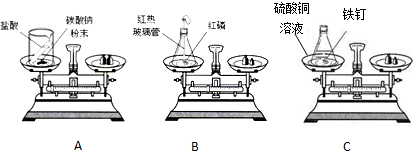
| 物质序号 | 甲 | 乙 | 丙 | 丁 |  |
| 微观 示意图 |  |  |  |  | |
| 反应前质量/g | 68 | 100 | 1 | 0 | |
| 反应后质量/g | 0 | x | y | z |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
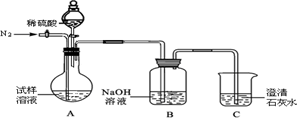
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
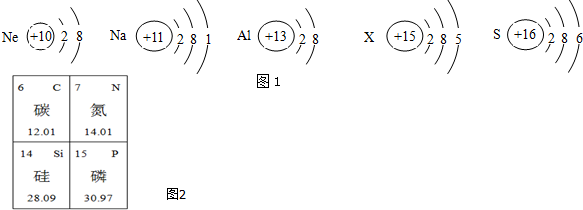
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com