
下图表示金属活动性顺序中铜、铁和铝被人类大规模开发、利用的大致年限。

(1)分析改图的规律,你认为金属被大规模开发、利用的先后顺序主要与 有关。
(2)科学小组的同学对模拟湿法炼铜实验中得到的铁、铜固体混合物进行含量测定,称取10克固体混合物置于烧杯中,滴加一定质量分数的稀硫酸溶液,记录并绘制了如图所示的曲线。

①10克固体混合物中铜的质量为 克;
②所用稀硫酸溶液溶质的质量分数是多少?(写出计算过程)
科目:初中化学 来源: 题型:
糕点疏松剂的主要成分中含有碳酸氢钠,某化学兴趣小组对碳酸氢钠的化学性质进行探究。
【探究实验一】碳酸氢钠溶液的酸碱性:用pH试纸测得碳酸氢钠溶液的pH约为10,由此得出结论是碳酸氢钠溶液呈____________。
【探究实验二】碳酸氢钠能否与酸反应:取少量固体放入试管中,滴加足量的稀盐酸,现象为______________。结论:碳酸氢钠能与酸反应。
【探究实验三】碳酸氢钠的热稳定性:取一定量的碳酸氢钠放在铜片上加热,如右图所示:
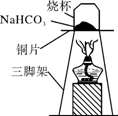
(1)加热一段时间后,观察到烧杯内壁有水珠。
(2)充分加热后,将烧杯迅速倒转过来,加入适量的澄清石灰水,振荡,观察到石灰水变浑浊。
(3)通过进一步实验来确定充分加热后的固体产物的成分。限选试剂及仪器:稀盐酸、氯化钙溶液、澄清石灰水、酚酞溶液、蒸馏水、试管、胶头滴管
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量加热后的固体产物放入试管A中,加入适量蒸馏水,充分振荡溶解,滴加足量____________,振荡,静置 | 产生白色沉淀 | 产物含Na2CO3 |
| ② | 取操作①后的上层清液于试管B中,滴加____________ | ____________ | 产物不含NaOH |
(4)根据上述实验结论,写出碳酸氢钠受热分解的化学方程式:__________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
现有锌和另一种金属组成的合金6.5g,洋洋同学向此合金中加入100g一定溶质质量分数的稀盐酸,充分反应后,发现金属完全消失,若产生氢气的质量为m。则下列判断正确的是
A.如果合金为锌和铁,m不可能是0.2g
B.反应后溶液中的溶质只有两种
C.如果合金为锌和镁,m可能是0.1g,则该合金中锌的质量分数为50%
D.如果合金为锌和铁,所加稀盐酸溶质质量分数一定大于7.3%
查看答案和解析>>
科目:初中化学 来源: 题型:
实验室用大理石与稀盐酸反应制取C02,反应后所得溶
液体积为40 mL(假设大理石中的杂质不与盐酸反应,反应
前后溶液体积不变)。向该溶液中匀速逐滴加入Na2C03溶液
并不断搅拌,测得溶液的pH随时间变化如图所示,该过程
共放出气体660 mL(密度为2.0 g/L),析出沉淀5.090
(1) 根据图像可以看出,Na2C03首先与溶液中的 反应。
(2)本实验制取CO2所用大理石中含CaC03 g。
(3)已知制取C02所用稀盐酸的密度为1.06 g/cm3,求这种盐酸的质量分数。(计算结果保留1位小数,无计算过程不给分)
查看答案和解析>>
科目:初中化学 来源: 题型:
在实验室里加热25g混有二氧化锰的氯酸钾固体混合物制取氧气,完全反应后剩余固体质量为15.4g。请计算
(1)生成氧气的质量为 g。
(2)反应前固体混合物中氯酸钾的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:
铜镁合金常用作飞机天线等导电材料。欲测定合金的组成(其他元素忽略不计),进行如下实验:取铜镁合金10g放入烧杯,将200g稀硫酸分4次加入烧杯中,充分反应后,测得剩余固体的质量记录如下。请计算:
| 次 数 | 1 | 2 | 3 | 4 |
| 加入稀硫酸质量/g | 50 | 50 | 50 | 50 |
| 剩余固体质量/g | 8.5 | 7 | 6.6 | 6.6 |
(1)铜镁合金中铜的质量。
(2)求所加稀硫酸中溶质的质量分数。(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
 某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图
某品牌纯碱中含有杂质NaCl,化学兴趣小组的同学进行了如下实验探究:称取12g样品放入烧杯中,加入稀盐酸至不再产生气泡为止,并绘制出加入稀盐酸的质量与放出气体质量的关系如图
(1)纯碱恰好完全反应时,生成CO2的质量为 g
(2)计算该样品中含杂质的质量分数 是多少?(计算结果保留一位小数,下同)
是多少?(计算结果保留一位小数,下同)
(3)计算当盐酸与纯 碱恰好完全反应时,所得溶液的溶质质量分数是多少?
碱恰好完全反应时,所得溶液的溶质质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
向20g CaCO3中不断地加入稀盐酸,其变化图像如右图所示。请回答以下问题:(1)当20g CaCO3完全反应时,所加稀盐酸的质量为 g。
(2)求所加稀盐酸的溶质质量分数为多少?
(写出计算过程)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com