
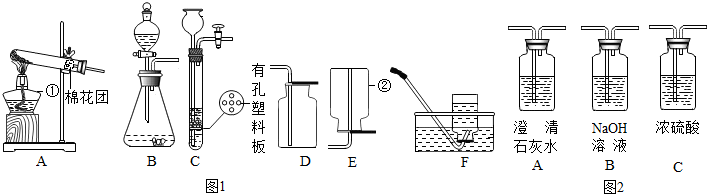
分析 (1)熟记常见仪器的名称;
(2)用高锰酸钾制氧气时需要加热,属于固体加热型,故选发生装置A;
(3)根据实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,二氧化碳能使石灰水变浑浊解答;
(4)C与B相比较其优点是可通过活塞的开闭控制反应的发生和停止,氢气的密度比空气小且难溶于水,可用向下排空气法或排水法收集;
(5)根据酸可以使石蕊试液变红及氯化氢能够和石灰水反应分析解答,注意二氧化碳本身不能使石蕊试液变色;
(6)①检验二氧化碳用澄清的石灰水;
②洗气装置要看瓶内加的试剂能否与气体中混有的杂质反应掉,干燥气体用浓硫酸.
解答 解:(1)标号仪器分别是酒精灯,集气瓶;
(2)高锰酸钾制取氧气发生装置的特点属于固体加热型的A装置;
(3)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,二氧化碳能使石灰水变浑浊,碳酸钙和稀盐酸反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(4)C装置中的有空塑料板上放锌粒,反应发生时打开活塞开关,硫酸从长颈漏斗内流下,与锌粒接触反应开始,当关闭开关时气体无法排出,压强越来越大,把硫酸又压回到长颈漏斗内,使锌粒与硫酸分离,所以反应停止,所以该装置可以控制反应的发生和停止;氢气密度小于空气的密度,难溶于水,所以用装置E或F收集;
(5)①酸可以使石蕊试液变红,乙同学用浓盐酸和大理石在B装置中反应,制取CO2并检验其有关性质,观察到烧杯中紫色石蕊试液变红.可能的原因有:产生的CO2与水反应生成H2CO3使石蕊试液变红;挥发出的氯化氢溶于水使石蕊试液变红;二氧化碳本身不能使石蕊变红;
②制得的气体通入澄清的石灰水中,石灰水没有变浑浊,是因为浓盐酸挥发出的HCl气体与石灰水反应;
(6)乙同学检查装置C气密性的操作和现象是:先用夹子夹住导气管中的橡皮管,再向长颈漏斗中加入水至形成一段水柱,静置,若观察到一段时间水柱液面不下降,说明气密性良好;故答案为:水面不下降;
(7)①检验CO中混有的CO2,要有明显的现象,即通入到石灰水中,石灰水变浑浊即可验证;
②除去二氧化碳用氢氧化钠溶液,因为氢氧化钠极易溶于水,氢氧化钙微溶于水,等量的水中溶解的氢氧化钠更多,能将二氧化碳除尽,浓硫酸具有吸水性,可用来干燥二氧化碳;所以要除去CO中较多CO2得到纯净干燥的CO,可先将气体通过氢氧化钠溶液,再通过浓硫酸;
故答案为:(1)酒精灯; 集气瓶;
(2)A;
(3)CaCO3+2HCl═CaCl2+H2O+CO2↑;
(4)可以控制反应的发生或停止;E(或F);
(5)①BC;②挥发出的氯化氢气体与石灰水反应;
(6)①A;②BC.
点评 本题考查知识综合而全面,很好的考查了学生对装置选取、反应原理、气体的性质等知识,解答时要结合相关知识细心分析,并明确如何对二氧化碳的验证和除去.


科目:初中化学 来源: 题型:推断题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 二氧化碳能溶于水 | B. | 二氧化碳能使澄清的石灰水变浑浊 | ||
| C. | 二氧化碳用作人工降雨 | D. | 二氧化碳能与水发生反应生成碳酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
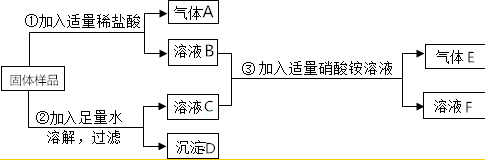
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 加入稀硫酸的质量(g) | 剩余固体质量(克) | |
| 第1次 | 10 | m |
| 第2次 | 10 | 8.4 |
| 第3次 | 10 | 7.6 |
| 第4次 | 10 | 7.1 |
| 第5次 | 10 | 7.1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
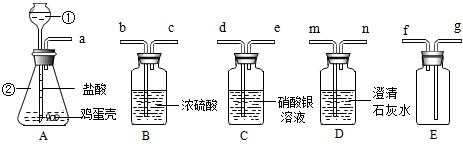
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验次数 | 氧化铜/g | 硫酸溶液/g | 硫酸铜/g |
| 1 | 2.0 | 120 | 4.0 |
| 2 | 4.0 | 120 | 8.0 |
| 3 | 6.0 | 120 | 9.6 |
| 4 | 8.0 | 200 | 16 |
| 5 | 10.0 | 200 | X |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 溶解度曲线是物质溶解性的直观体现.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )
溶解度曲线是物质溶解性的直观体现.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是( )| A. | b物质可能是熟石灰 | |
| B. | a物质的溶解度大于b物质 | |
| C. | 使c物质结晶析出可以采用降温的方法 | |
| D. | t2时a、b两种物质饱和溶液的溶质质量分数相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫在空气中燃烧,产生蓝紫色火焰 | |
| B. | 将二氧化碳通入水中,无明显现象 | |
| C. | 红亮的铜丝在酒精灯火焰上灼烧,铜丝表面变黑 | |
| D. | 一氧化碳通过灼热的氧化铁,红色固体变黑 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com