
| 溶解度 | 10℃ | 20℃ | 30℃ | 40℃ |
| Na2CO3 | 12.5g | 21.5g | 39.7g | 49.0g |
| NaHCO3 | 8.1g | 9.6g | 11.1g | 12.7g |
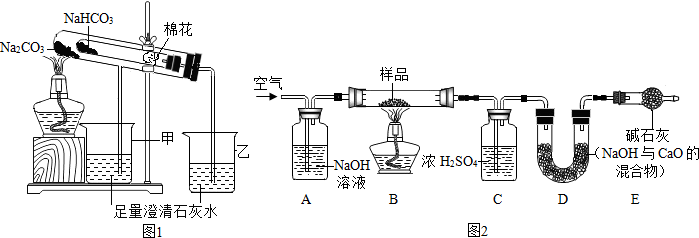
分析 【探究一】
(1)根据溶液pH值分析酸碱性解答;据测定溶液酸碱度的方法以及溶液的酸碱度与酸碱性的关系来分析;
(2)根据碳酸氢钠加热分解为碳酸钠、水和二氧化碳,二氧化碳能和澄清的石灰水变浑浊来分析;
(3)根据20℃时碳酸钠和碳酸氢钠的溶解度来分析;
【探究二】
(4)根据实验前先通一段时间的空气的目的是排尽装置内的空气(或二氧化碳)解答;
(5)根据空气经过装置A时,其中的二氧化碳与氢氧化钠反应生成碳酸钠和水,若没有此装置,则装置D增重偏大,认为生成的二氧化碳质量偏大解答;
(6)根据停止加热后,仍继续通入空气一段时间,目的是使反应生成的二氧化碳全部被D吸收解答;
【含量测定】
(7)根据反应前后固体减少的质量为生成的二氧化碳的质量,利用反应的化学方程计算解答;
(8)根据反应原理写出反应的化学方程式解答.
解答 解:
【探究一】(1)根据溶液pH值可知:Na2CO3溶液和NaHCO3溶液显碱性,滴加紫色石蕊试液,均蓝色;溶液的碱性越强,pH越大,NaHCO3溶液<Na2CO3溶液;
(2)碳酸氢钠加热分解为碳酸钠、水和二氧化碳,氢氧化钙和二氧化碳反应生成碳酸钙和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;在受热条件下,碳酸钠比碳酸氢钠稳定性强;
(3)20℃时碳酸钠和碳酸氢钠的溶解度分别为21.5g和9.6g,那么在该温度下,10g水中最多溶解2.15g碳酸钠达到饱和,最多溶解0.96g碳酸氢钠达到饱和,因此可分别加入2g固体,充分搅拌后,若完全溶解则为碳酸钠,若不能完全溶解则为碳酸氢钠;故填:A;
【探究二】
(4)实验前先通一段时间的空气的目的是排尽装置内的空气(或二氧化碳);
(5)气经过装置A时,其中的二氧化碳与氢氧化钠反应生成碳酸钠和水,若没有此装置,则装置D增重偏大,认为生成的二氧化碳质量偏大;造成测定结果偏大;
(6)停止加热后,仍继续通入空气一段时间,目的是使反应生成的二氧化碳全部被D吸收;
【含量测定】
(7)设10.0g样品中含碳酸氢钠的质量x
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
168 44
x 124.4g-122.2g
$\frac{168}{x}$=$\frac{44}{124.4g-122.2g}$
x=8.4g
该样品中碳酸氢钠的质量分数为$\frac{8.4g}{10g}$×100%=84%
(8)向Na2CO3溶液中通入CO2气体可以生成NaHCO3,该反应的化学反应方程式为:Na2CO3+CO2+H2O═2NaHCO3
故答案:
【探究一】
(1)蓝色;<
(2)CO2+Ca(OH)2═CaCO3↓+H2O;强;
(3)A;
【探究二】
【问题讨论】
(4)排尽装置内的空气(或二氧化碳);
(5)吸收鼓入空气中的二氧化碳,偏大
(6)使反应生成的二氧化碳全部被D吸收.
【含量测定】
(7)解:设10.0g样品中含碳酸氢钠的质量X
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
168 44
x 124.4g-122.2g
$\frac{168}{x}$=$\frac{44}{124.4g-122.2g}$
x=8.4g
该样品中碳酸氢钠的质量分数为8.4g/10.0g×100%=84%
【知识拓展】
(8)Na2CO3+CO2+H2O═2NaHCO3
点评 本题考查碳酸氢钠含量的测定实验,为高频考点,把握实验装置的作用及实验目的为解答的关键,侧重分析、计算及实验能力的综合考查,题目难度中等.


科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 沼气池清理作业前进行灯火试验 | |
| B. | 室内起火,迅速打开所有门窗通风 | |
| C. | 发生一氧化碳中毒,立即转移到通风的地方救治 | |
| D. | 夜间发生液化气泄漏,开灯进行检查 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com