
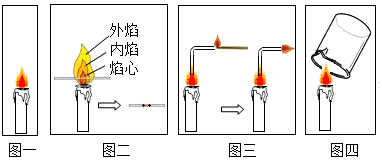
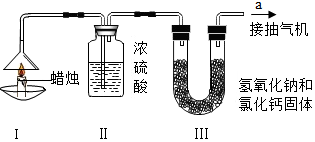
| 蜡烛 | 装置Ⅱ | 装置Ⅲ | |
| 反应前的质量/g | 15.8 | 182.3 | 212.2 |
| 反应后的质量/ | 14.4 | 184.1 | 216.6 |
分析 (1)根据题意正确分析现象,从石蜡的物理性质进行思考;
(2)根据蜡烛的现象解答;
(3)根据蜡烛的外焰的温度最高来解答该题;
(4)根据蜡烛火焰中的蜡烛蒸气燃烧而产生的,焰心的物质具有可燃性解答;
(5)根据石蜡燃烧产物是二氧化碳与水,以及水和二氧化碳的检验方法进行解答;
(6)要测定蜡烛中碳氢元素的质量比,需从其燃烧的产物二氧化碳和水的质量着手,化学反应前后元素的质量不变.要测定水的质量,可以使用浓硫酸来吸收,要测定二氧化碳的质量,可使用氢氧化钠溶液来吸收,需要先测水的质量,再测二氧化碳的质量.要准确测定水和二氧化碳的质量,需要排除空气中水和二氧化碳的干扰.
解答 解:
(1)用小刀可以切下蜡烛,说明蜡烛比较软;蜡烛漂浮于水面,说明蜡烛的密度小于水的密度;
(2)蜡烛燃烧发光、发热;
(3)蜡烛的外焰温度最高,所以可以观察到靠近蜡烛外焰处的火柴梗最先碳化;
(4)在玻璃管的另一端点燃,另一端产生火焰,这说明焰心物质的状态为气态,焰心物质的性质具有可燃性;导管里气体可能会是石蜡蒸汽;
(5)烧杯内壁产生了液体,说明蜡烛燃烧产生了水,而澄清石灰水变浑浊,说明产生了二氧化碳;即蜡烛燃烧生成了二氧化碳和水.
(6)
①分析表格,装置二盛放的是浓硫酸,吸收的是水,原来质量是182.3g,后来是184.1g,所以生成水的质量是:184.1g-182.3g=1.8g,装置三盛放的是氢氧化钠溶液,吸收的是二氧化碳,原来质量是212.2g,后来是216.6g,所以生成二氧化碳的质量是:216.6g-212.2g=4.4g;
②1.8g水含氢元素的质量为:1.8g×$\frac{2}{18}$=0.2g,4.4g二氧化碳含碳元素的质量为:4.4g×$\frac{12}{44}$=1.2g,所以碳氢元素的质量比为:1.2g:0.2g=6:1;
③根据质量守恒定律,参加反应的各物质的质量和等于生成的各物质的质量和,消耗的蜡烛+氧气=水+二氧化碳,所以装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛失去的质量,所以本题答案为:与消耗的蜡烛比较,生成的二氧化碳和水中增加了参加反应的氧气所含氧元素质量;
④要准确测出蜡烛燃烧生成二氧化碳和水的质量,需要排除空气中原有的二氧化碳和水,而本题的装置中没有除水和除二氧化碳的装置,故测定的结果不准确.
答案:
答案:
(1)红色固体不溶于水密度比水小
(2)发光、发热、燃烧等
(3)外焰
(4)石蜡蒸汽
(5)水珠 石灰水变浑浊 不正确
(6)
①1.8
②6:1
③与消耗的蜡烛比较,生成的二氧化碳和水中增加了参加反应的氧气所含氧元素质量
④不能,空气中的水和二氧化碳也能被装置Ⅱ、装置Ⅲ吸收
点评 本题主要测试学生的实验操作能力和方法的掌握情况,以及学生对石蜡的性质的了解,如果学生了解石蜡的成分,并能正确分析实验现象,就能正确解答.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
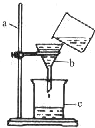 如图是某同学用来除去水中难溶性杂质时所采用的过滤装置图.试回答:
如图是某同学用来除去水中难溶性杂质时所采用的过滤装置图.试回答:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 伦敦奥运会于2012年7月27日开幕,有17000名运动员和官员参加这次盛会.
伦敦奥运会于2012年7月27日开幕,有17000名运动员和官员参加这次盛会.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 氯化钾 | 氯化钙 | 氯化钠 | 氯化镁 | 氯化铝 | 氯化锌 | 氯化亚铁 | 氯化铜 |
| KCl | CaCl2 | NaCl | MgCl2 | AlCl3 | ZnCl2 | FeCl2 | CuCl2 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com