
用28 g铁粉和28 g镁粉分别与足量的稀硫酸反应都生成l g氢气,由此可以得出的结论是相对原子质量:Fe-56,H-1,Mg-24
A.铁粉、镁粉都含有杂质 B.铁粉、镁粉都是纯净物
C.铁粉是纯净物,镁粉含杂质 D.铁粉含杂质,镁粉是纯净物
科目:初中化学 来源: 题型:
 (2013?荆门)某化学兴趣小组使用右图所示装置,对某种铁铜合金的成分进行测量.先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题:
(2013?荆门)某化学兴趣小组使用右图所示装置,对某种铁铜合金的成分进行测量.先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题:| 空烧杯 | 加入 硫酸后 |
加入铁粉后 5分钟 |
加入铁粉后 12分钟 |
加入铁粉后 21分钟 |
加入铁粉后 40分钟 |
加入铁粉后 3小时 | |
| 读数(g) | 28.5 | 169.7 | 183.6 | 183.5 | 183.4 | 183.3 | 183.3 |
查看答案和解析>>
科目:初中化学 来源:2008年江苏省扬州市初中毕业升学统一考试、化学试卷 题型:058
无焰食品加热器常用于野外加热食物,它的成分是镁粉、铁粉、氯化钠.使用时加入水,镁与水反应产生热量.下面是在18℃、标准大气压的环境中对该产品的实验研究,请结合以下实验方案回答有关问题(不考虑氯化钠对水沸点的影响).
实验1:
Ⅰ、将一定质量的镁条、铁粉和氯化钠加入盛有100 mL水的隔热容器中,连续搅拌,每50 s记录一次温度,得图1中曲线a;
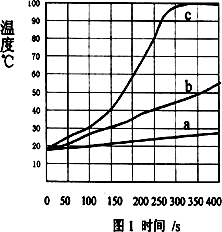
Ⅱ、将相同质量的镁条剪成100份代替Ⅰ中镁条重复以上实验,得图1中曲线b;
Ⅲ、用相同质量的镁粉代替Ⅰ中镁条重复以上实验,得图1中曲线c.
(1)从能量变化角度看,该变化是________能转化为________能.
(2)观察图1,从中可以发现影响镁和水反应速率的因素是________.
实验2:将2.40 g镁粉和质量为28.00 g的铁粉混合,加入盛有100 mL水的隔热容器中,不断搅拌.氯化钠用量不同时,温度变化情况如图2所示.
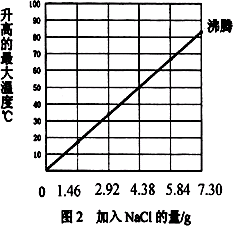
(3)实验2中,当NaCl质量大于7.30 g时,实验不再做的原因是________.
A.加入更多的NaCl不再增加反应速率
B.加入更多的NaCl会降低反应速率
C.已达到水的沸点,温度不会再有变化
D.需加入更多的铁粉来提高水的温度
(4)如果在实验2中加入质量为3.65 g NaCl,混合物的温度最高大约是________.
(5)某同学设计了下面四种无焰食品加热器物料配方,请根据本次实验研究的结论,判断其中最合理的是________.
A.2.40 g镁粉、7.30 g NaCl和28.00 g铁粉
B.2.40 g镁条、7.30 g NaCl和28.00 g铁粉
C.2.40 g镁粉、8.76 g NaCl和28.00 g铁粉
D.2.40 g镁条、8.76 g NaCl和28.00 g铁粉
理由是_________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
 某化学兴趣小组使用右图所示装置,对某种铁铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题:
某化学兴趣小组使用右图所示装置,对某种铁铜合金的成分进行测量。先取足量稀硫酸于烧杯中,再向其中加入14.0g合金样品开始计时,并将电子天平的读数记录在下表中,请回答下列问题:
⑴根据电子天平读数和时间的关系分析,该反应进行过程中,氢气
的产生速度有什么特点?
⑵完全反应后,烧杯中盐的质量分数为多少?(用百分数表示)
⑶合金中铁元素的质量百分含量为多少?
| 空烧杯 | 加入 硫酸后 | 加入铁粉后 5分钟 | 加入铁粉 12分钟 | 加入铁粉后 21分钟 | 加入铁粉后 40分钟 | 加入铁粉后 3小时 | |
| 读数(g) | 28.5 |
| 183.6 | 183.5 | 183.4 | 183.3 | 183.3 |
查看答案和解析>>
科目:初中化学 来源: 题型:
用28 g铁粉和28 g镁粉分别与足量的稀硫酸反应都生成l g氢气,由此可以得出的结论是( )
A.铁粉、镁粉都含有杂质 B.铁粉、镁粉都是纯净物
C.铁粉是纯净物,镁粉含杂质 D.铁粉含杂质,镁粉是纯净物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com