
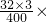 100%=24%.
100%=24%.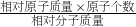 ×100%,进行分析解答.
×100%,进行分析解答.

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2005?东城区二模)某同学归纳元素化合物的知识网络如图所示,其中A、B、C、D是四种不同的含铁化合物.A是铁锈的主要成分,E、F是二种无色溶液.根据以上信息推断:
(2005?东城区二模)某同学归纳元素化合物的知识网络如图所示,其中A、B、C、D是四种不同的含铁化合物.A是铁锈的主要成分,E、F是二种无色溶液.根据以上信息推断:查看答案和解析>>
科目:初中化学 来源: 题型:
 即将在苏州市建成的“东方之门”是由钢筋混凝土制成的世界最大门型建筑,创下“中国第一大高楼”等7项全国之最,大楼用去了相当于建造八艘航空母舰的钢铁.根据你所学的化学知识回答:
即将在苏州市建成的“东方之门”是由钢筋混凝土制成的世界最大门型建筑,创下“中国第一大高楼”等7项全国之最,大楼用去了相当于建造八艘航空母舰的钢铁.根据你所学的化学知识回答:查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com