
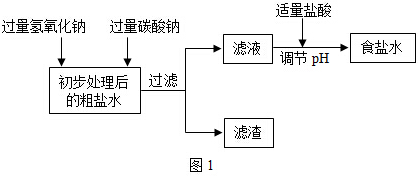
分析 【步骤一】
(1)碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,据此写化学方程;
(2)根据粗盐中的杂质和所加试剂的反应进行分析;
(3)根据溶液的酸碱性及酸碱指示剂的变色情况分析;
(4)根据除杂质的原则,不引入新杂质分析;
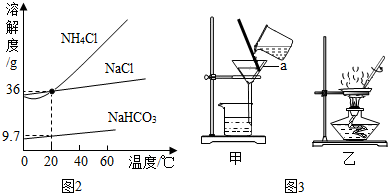
【步骤二】
(1)根据氯化钠和氯化铵的溶解度曲线分析;
(2)根据11.7g的NaCl或15.8g的NH4HCO3,进行化学方程式计算,求得生成NaHCO3的质量,进而求出实际上从溶液中析出NaHCO3的固体质量;
(3)根据分离固、液体的操作选装置,分析玻璃棒的作用;
(4)根据如图3所示玻璃仪器写出名称;
【步骤三】根据题目信息写出化学方程式即可.
解答 解:【步骤一】
(1)碳酸钠与氯化钙反应生成碳酸钙和氯化钠,其化学方程式为CaCl2+Na2CO3=2NaCl+CaCO3↓;
(2)粗盐水中含有氯化镁和氯化钙等杂质,加入过量的氢氧化钠溶液和碳酸钠溶液后充分反应后,生成氯化钠,所以滤液中还有剩余的氢氧化钠溶液和碳酸钠溶液;
(3)碳酸钠和氢氧化钠溶液都显碱性,遇无色酚酞变红,当溶液由红色变为无色时,溶液变为中性;
(4)流程中不用硫酸调节溶液pH的原因是会产生Na2SO4,引入新杂质;
【步骤二】
(1)有图象可知:相同条件下,氯化钠的溶解度大于氯化铵,应满足的温度范围是0-20℃;
(2)设理论上生成的碳酸氢钠质量为x.
NaCl+NH4HCO3═NaHCO3↓+NH4Cl
58.5 84
11.7g X【或用15.8g NH4HCO3计算也可】
$\frac{58.5}{11.7g}=\frac{84}{x}$
X=16.8g
实际析出NaHCO3固体的质量为:16.8g-9.7g=7.1g;
(3)固液分离应选择图3中的甲过滤装置,玻璃棒在该操作中的作用是引流;
(4)如图3所示玻璃仪器a的名称是漏斗;
【步骤三】
碳酸氢钠加热后的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
故答案为:
【步骤一】(1)CaCl2+Na2CO3=2NaCl+CaCO3↓
(2)NaCl、Na2CO3和NaOH (2分)
(3)A (4)会带入新的杂质【或增加SO42-离子、产生Na2SO4均可】
【步骤二】
(1)0℃<t<20℃
(2)解:设理论上生成的碳酸氢钠质量为x.
NaCl+NH4HCO3═NaHCO3↓+NH4Cl
58.5 84
11.7 g X【或用15.8 g NH4HCO3计算也可】
$\frac{58.5}{11.7g}=\frac{84}{x}$
X=16.8 g
实际析出NaHCO3固体的质量为:16.8 g-9.7 g=7.1 g
答:理论上生成的碳酸氢钠为16.8 g.实际析出NaHCO3固体为7.1 g.
(3)甲 引流
(4)漏斗
【步骤三】2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
点评 本题难度比较大,涉及粗盐提纯的原理、除杂的原理、侯氏制碱法的原理等理论内容,要通过该题认真总结解题思路.


 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:初中化学 来源: 题型:选择题
| A. | 没有发生物理变化 | B. | 发生了化学变化 | ||
| C. | 元素的种类发生了变化 | D. | 该变化不遵守质量守恒定律 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 人体缺乏维生素C(简写“Vc”)会患坏血病.如图所示为某种“维生素C”说明书的一部分,请计算:
人体缺乏维生素C(简写“Vc”)会患坏血病.如图所示为某种“维生素C”说明书的一部分,请计算:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁钉生锈后质量增加 | B. | 煤燃烧后质量减轻 | ||
| C. | 双氧水分解后质量减少 | D. | 10g的冰融化后变为10g的水 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 置换反应生成单质和化合物,因此生成单质和化合物的反应都是置换反应 | |
| B. | 中和反应生成盐和水,生成盐和水的反应都是中和反应 | |
| C. | 将HCl和SO2分别通入石蕊试液中,溶液都变为红色,所以它们都是酸性物质 | |
| D. | 碳和氢气都能夺取氧化铜中的氧,它们都具有还原性 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
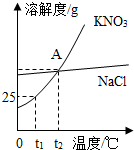 如图是KNO3和NaCl的溶解度曲线.试回答下列问题:
如图是KNO3和NaCl的溶解度曲线.试回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com