
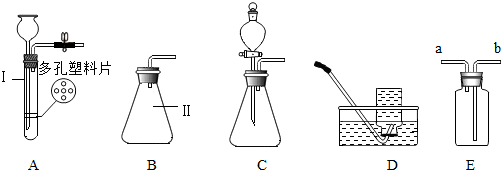
分析 试管、锥形瓶都是常用的反应容器;制取装置包括加热和不需加热两种,如果用双氧水和二氧化锰制氧气就不需要加热,如果用高锰酸钾或氯酸钾制氧气就需要加热.氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集.用排水法收集氧气,实验结束应先移出导管,后熄灭酒精灯,其原因是:防止水倒流,使试管炸裂.实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳可以用浓硫酸干燥.实验室是用锌粒和稀硫酸在常温下反应制氢气的,氢气难溶于水,密度比空气的密度小,因此可以用排水法和向下排空气法收集;A装置可用锌粒与稀硫酸来制氢气,锌粒放在多空塑料片上,该装置的最大优点是:随时控制反应的发生与停止.
解答 解:(1)试管、锥形瓶都是常用的反应容器,故答案为:试管、锥形瓶
(2)如果用双氧水和二氧化锰制氧气就不需要加热,如果用氯酸钾和二氧化锰制氧气就需要加热;氧气的密度比空气的密度大,不易溶于水,因此能用向上排空气法和排水法收集;若用E装置来收集较为干燥的氧气,则应从长管进入,因为氧气的密度比空气的密度大;用排水法收集氧气,实验结束应先移出导管,后熄灭酒精灯,其原因是:防止水倒流,使试管炸裂;故答案为:H2O2、2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑、b、将导管移出水槽.
(3)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集;二氧化碳可以用浓硫酸干燥;故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑、浓硫酸;
(4)A装置可用锌粒与稀硫酸来制氢气,锌粒放在多空塑料片上,该装置的最大优点是:随时控制反应的发生与停止;故答案为:随时控制反应的发生与停止
点评 本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和注意事项等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实驗方案 |
| A | 检验露罝空气中的NaOH固体是否变质 | 加入适量稀盐酸.观察是否产生气泡 |
| B | 鉴别硝酸铵和氢氧化钠固体 | 分别加足量水溶解,观察现象 |
| C | 粗略测定空气中氧气的含量 | 用铁丝代替铜粉进行实验 |
| D | 实验室制取氧气 | 将过氧化氢溶液催化分解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 实验步骤及现象 | 实验结论(填离子符号) |
| 取废水样品观察,呈无色 | 废水中不含Cu2+ |
| 测所取废水样品的pH,pH=13 | 废水中含较多的OH-,没有H+、NH4+ |
| 向废水样品中加入过量的稀盐酸,没有气泡产生 | 废水中不含CO32- |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
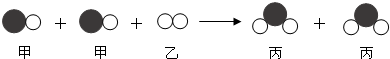
| A. | 该反应属于化合反应 | B. | 该反应前后原子个数保持不变 | ||
| C. | 该反应遵循质量守恒定律 | D. | 甲和丙中同种元素的化合价均相等 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 操作方法 |
| A | CaO粉末(CaCO3粉末) | 加足量的水,充分搅拌后过滤 |
| B | Fe(Fe2O3) | 加入过量稀盐酸,充分反应后过滤 |
| C | CuSO4溶液(H2SO4) | 加入过量CuO粉末,加热,充分反应后过滤 |
| D | CO2(HCl) | 通过盛有氢氧化钠溶液的洗气瓶 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | X一定是CuCl2 | B. | Y中阴离子的化合价为-2 | ||
| C. | 该反应类型为置换反应 | D. | X的相对分子质量比Y大 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 在做完常见酸碱盐性质的实验后,课外小组的同学帮助老师整理实验用品,发现有一个失去标签的试剂瓶(如图),里面盛有无色、无味的液体,老师建议他们通过实验方法给予确认,大家进行了讨论和探究.请你也来参与吧.
在做完常见酸碱盐性质的实验后,课外小组的同学帮助老师整理实验用品,发现有一个失去标签的试剂瓶(如图),里面盛有无色、无味的液体,老师建议他们通过实验方法给予确认,大家进行了讨论和探究.请你也来参与吧.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验序号 | A | B | C | D |
| 试剂 | 蒸馏水 | 稀盐酸 | NaOH溶液 | NaCl溶液 |
| 电流强度/mA | 约为0 | 0.09 | 0.09 | 0.09 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com