
t℃时,24g镁与一定量的稀盐酸恰好完全反应,反应后得到不饱和溶液,其溶质质量分数为25%。求所用盐酸中溶质的质量分数。(答案保留0.1%,写出解题过程)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:计算题
(8分)某同学称取a g铜锌合金,加入足量稀硫酸,充分反应后测得生成气体的质量为b g,剩余固体经过滤、洗涤、干燥后,称得质量为c g.请问:
(1)a g铜锌合金中锌的质量为 g(用代数式表示).
(2)根据化学反应方程式,推导出a、b、c三者之间的等量关系(写出详细的计算推导过程).
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金(Cu-Zn),它可用来制造电器零件及日用品。小华利用一瓶稀盐酸和相关的仪器,测定黄铜样品的组成(不考虑黄铜中的其他杂质)。将30mL稀盐酸分三次加入到10g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
(1)从上表数据分析,小华用10g合金粉末总共收集到氢气 g;
(2)求该合金中铜的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
黄铜是铜和锌的合金,可以用来制造机器、电器零件及日用品。为了测定某黄铜样品中铜的质量分数,取20g该样品向其中加入一定量的稀硫酸,恰好完全反应,产生氢气的质量与加入稀硫酸的质量关系如图所示。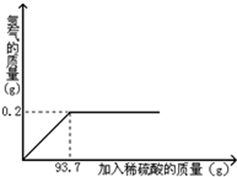
(1)完全反应后,生成H2的质量为 g。
(2)完全反应后所得溶液的溶质质量分数是多少
(保留一位小数)?
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
我国约在南北朝时就开始冶炼黄铜。黄铜是铜和锌的合金(Cu-Zn),它可用来制造机器、电器零件及日用品。为了测定某黄铜样品中锌的质量分数(不考虑黄铜中的其他杂质),现将15 mL稀盐酸分三次加入到5 g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
| | 第一次 | 第二次 | 第三次 |
| 加入稀盐酸的体积(mL) | 5 | 5 | 5 |
| 生成氢气的质量(g) | 0.04 | m | 0.02 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
进行如图所示的化学实验(装置气密性良好),通过二氧化碳中碳元素与氧元素的质量比来证明二氧化碳的组成,探究过程如下: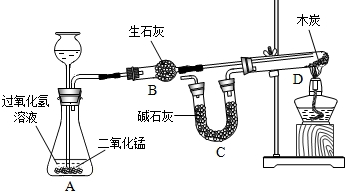
Ⅰ.称量有干燥块状木炭的试管D,质量为a g,装有碱石灰的C装置质量为b g,连接A、B、D装置;
Ⅱ.从长颈漏斗中加入3%的过氧化氢溶液,连接C装置,点燃酒精灯;
Ⅲ.待D中发生反应,熄灭酒精灯,冷却;
Ⅳ.称量试管D及剩余固体质量为cg,装置C的质量为dg;
已知:碱石灰用于吸收二氧化碳,木炭中的杂质不参加反应,B、C中所装药品能完全吸收相关物质.请回答下列问题:
①二氧化锰的作用是 ,装置B的作用是 ,B中发生反应的化学方程式为 ;
②为减少误差,步骤Ⅲ冷却过程中需要注意的问题是 ;
③除②中注意的问题外,该实验过程中还存在一定的误差,你认为产生误差的原因是 ;
④这个实验中如果生成的氧气的质量为16克,则需要参加反应的过氧化氢的物质的量为多少摩尔?(根据化学方程式计算,写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
科学实验提倡绿色环保,对实验装置进行微型化改进是一条很好的途径。图甲是实验室制取并检验CO2的装置,图乙是对图甲实验装置的“微型”化改进后的装置。
(1)图乙中微型塑料滴管在实验中的作用与图甲中的 仪器相同(填字母编号)。
(2)通常用甲装置完成该实验需要的盐酸是“微型”实验装置用量的10倍,采用“微型”实验装置具有的优点是 。
(3)用乙装置完成“制取并检验CO2”的实验,消耗了0.73克10%的盐酸。请计算实验过程中产生CO2的质量是多少克?【(2分);相对原子质量:Ca-40;H-1;C-12;O-16;Cl-35.5】
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
将6.8 g含杂质的锌粒,加入到盛有50.0 g过量的稀硫酸的烧杯中(杂质不溶于水,也不与稀硫酸反应),充分反应后,称得烧杯内物质的总质量为56.6 g。试计算:
(1)生成氢气的质量。 (2)锌粒中所含锌的质量分数(精确到0.1%)。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
煤是一种化石燃料,用煤作燃料生成的SO2气体会造成环境污染。有一种煤每燃烧1 t就会释放出53.3 kg SO2。如果将产生的SO2用熟石灰来完全吸收,其反应的化学方程式为:SO2+Ca(OH)2=CaSO3+H2O,那么燃烧5 t这种煤产生的SO2在理论上需用多少千克的Ca(OH)2来吸收(计算结果取整数)?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com