
分析 分析所发生的反应,可发现反应后总质量减轻是由于生成了气体二氧化碳,根据质量守恒定律可求出二氧化碳的质量.然后利用二氧化碳的质量,根据反应的化学方程式,计算恰好完全反应时碳酸钙的质量,最后使用质量分数的计算公式,求出样品中碳酸钙的质量分数.
解答 解:生成二氧化碳的质量为:12.5g+146g-154.1g=4.4g;
设样品中CaCO3的质量为x,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 4.4g
$\frac{100}{x}$=$\frac{44}{4.4g}$
x=10g
样品中碳酸钙的质量分数是:$\frac{10g}{12.5g}$×100%=80%.
答:(1)反应生成二氧化碳质量为2.2g;
(2)样品中碳酸钙的质量分数为80%.
点评 根据反应的化学方程式能表示反应中各物质的质量关系,由反应中某物质的质量可计算出反应中其它物质的质量.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题

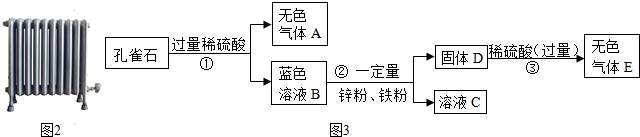
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 物 质 | 甲 | 乙 | 丙 |
| 未溶解固体的质量/g | 7 | 0 | 3 |
| A. | 升高温度,三溶液中溶质的质量分数一定会改变 | |
| B. | 三溶液中溶质的质量分数乙>丙>甲 | |
| C. | 所得溶液可能都是饱和溶液 | |
| D. | 20℃时,甲的溶解能力最小 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
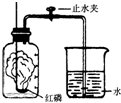 某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:
某同学设计了测定空气中氧气含量的实验,实验装置如图.该同学的实验步骤如下:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 溶液的溶质可以是一种或几种 | |
| B. | 溶液一定是无色.澄清.透明的 | |
| C. | 浓溶液一定是饱和溶液 | |
| D. | 饱和溶液析出晶体后溶质质量分数一定增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com