

| ���� | ���� | ���ͻ���� |
| ��ȡ�����������Թ��У�������ˮ�����ִ��� �Թ���ڣ����ã����� ������ɫ��̪��Һ | �Թ���ڷ��̣� ��̪��Һ���ɫ�� | ˵��ʣ������к��������ƣ������� ����ˮ�����������ƣ�ͬʱ�ų�����ų��������ա��������� |
| ����ȡ������������һ �Թ��еμӹ���ϡ���� | �Թ��������ݲ��� | ˵��ʣ������к���̼��ƣ� |
| ʱ�� | ������Ŀ | ����/g |
| ��Ӧ��ʼǰ | װ��+ϡ����+���� | 171.0 |
| ��Ӧ������ | װ��+ϡ����+���� | 166.6 |
���� ��1��̼��Ƹ����ֽܷ����������ƺͶ�����̼��
��2������������ˮ��Ӧ�����������ƣ���������������ˮ�����ʣ���ˮ��Һ�ʼ��ԣ�̼����������ᷴӦ���ɶ�����̼���壻
��3���Աȷ������е����ݣ���������������̼��������
��4��̼�����ϡ���ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��
��5�����ݻ�ѧ�����ǵļ������ö�����̼�����������Ӧ��̼��Ƶ������������õ���Ʒ��CaCO3������������
��6����������̼û����ȫ�ų��ᵼ�½��ƫ�ͣ�
��7����������ˮ��Ӧ�����������ƣ�
��8���Ӳ���������ƫ���ԭ����������
��� �⣺��1��̼��Ƹ��������ֽܷ����������ƺͶ�����̼�����CaCO3$\frac{\underline{\;����\;}}{\;}$CaO+CO2����
��2��ȡ�����������Թ��У�������ˮ���ã��ִ����Թ���ڸо����̣��ٵμ�����ɫ��̪��Һ����Һ��죬˵������ɷ���һ�����������ƣ���ȡ������������һ�Թ��еμӹ���ϡ���ᣬ���������ɣ�˵������ɷ���һ������̼��ƣ�
���
| ���� | ���� | ���ͻ���� |
| ��ȡ�����������Թ��У�������ˮ�����ִ��� �Թ���ڣ����ã����� ������ɫ��̪��Һ | �Թ���� ���̣� ��̪��Һ�� ��ɫ�� | ˵��ʣ������к��������ƣ������� ����ˮ�����������ƣ�ͬʱ �ų�����ų��������ա��������� |
| ����ȡ������������һ �Թ��еμӹ���ϡ���� | �Թ����� ���ݲ��� | ˵��ʣ������к���̼��ƣ� |
���� ������һ��ʵ��̽���⣬����Ĺؼ������������Ŀ�е���Ϣ���̽���������йصķ�Ӧ���з����жϣ���Ŀ�ѶȲ���ע�ػ������ܽϺõ�ѵ����ǿ��ѧ����ѧ�Ļ���֪ʶ



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2017�����ʡ���꼶�п�һģ��ѧ�Ծ��������棩 ���ͣ�ѡ�������
��һ��������þ��п������ĩ���뵽һ������������ͭ��Һ�У�����Ӧֹͣ���˵���������Һ�����������м���������ϡ���ᣬ���������ܽ������������ɣ�������˵����ȷ���ǣ�����
A. ������һ����þ��ͭ B. ������һ����þ��п��ͭ
C. ��Һ��һ��������ͭ������п D. ��Һ��һ��������þ��һ��û������ͭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 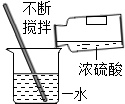 ϡ��Ũ���� | B�� |  Һ�����ȡ | ||
| C�� |  ��Һ����� | D�� |  ���Թ�����������ĩ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����õĵ����ԡ������� | B�� | �ܶȽϴ��۵�ϵ� | ||
| C�� | ������ɫ�Ĺ��� | D�� | ���ǻ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ij��ѧ�С���ԡ�����ε����ʡ�Ϊ�������̽��ѧϰ���ܽ����������Ƶ�������ѧ���ʣ�
ij��ѧ�С���ԡ�����ε����ʡ�Ϊ�������̽��ѧϰ���ܽ����������Ƶ�������ѧ���ʣ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
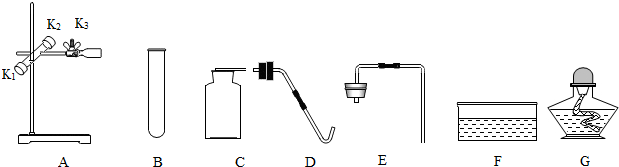
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com