
【题目】以饱和NaCl溶液和饱和NH4HCO3溶液为原料制备NaHCO3的原理为:NaCl+NH4HCO3═NaHCO3↓+NH4Cl。(已知NH4HCO3在40℃受热易分解)回答下列问题:
(1)该反应中的几种物质溶解度曲线如图所示:
①35℃时,比较A、B溶解度的大小:A_____B(填“<”或“>”)。
②图中表示NaHCO3溶解度曲线的是_____(填“A”或“B”) 。
(2)为探究NaHCO3析出的最佳条件,完成了如图几组实验

实验序号 | 反应温度/℃ | 反应时间/min | NaHCO3产率/% |
a | 30 | 60 | 86.8 |
b | 30 | 120 | X |
c | 35 | 60 | 89.4 |
d | 35 | 120 | 92.5 |
e | 40 | 60 | 85.3 |
f | 40 | 120 | 85.6 |
①实验c和d的目的是_________。
②表格中X的数值可能为___________。A.85.8 B.86.8 C.92.1 D.93.1
③在相同反应时间,40℃时NaHCO3的产率比35℃时低的原因是_________。
【答案】> B 探究反应时间对产物产率的影响 C 在40℃时NH4HCO3受热容易分解,导致反应物减少
【解析】
(1)①观察图中 35℃时物质A的溶解度曲线在物质B的上方,35℃时,A的溶解度大于B的溶解度;
②由NaCl+NH4HCO3═NaHCO3↓+NH4Cl可知,碳酸氢钠容易析出结晶形成沉淀,即在同温度下碳酸氢钠的溶解度应该比碳酸氢铵小,图中表示NaHCO3溶解度曲线的是B;
(2)①实验c、d的反应温度相同,而反应时间不同,因此是探究反应时间对产物产率的影响;
②由实验a、c、e可得:当反应时间相同,反应温度上升的过程中,产率是先上升再下降(下降是因为碳酸氢铵在 40℃时易分解),因此实验 b、d、f 产率也应符合这一规律,因此X应大于86.8而小于92.5,C符合要求;
③由题意可得,在40℃时NH4HCO3受热容易分解,导致反应物减少。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】下图是a、b、c(均不含结晶水)三种物质的溶解度曲线,下列分析不正确的是( )
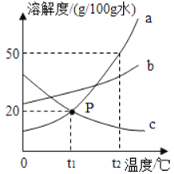
A. t2℃时a、b、c三种物质的溶解度由大到小的顺序是a>b>c
B. t2℃时,将30ga物质放入50g水中充分溶解得到80g溶液
C. 将t2℃时a、b、c三种物质的饱和溶液降温至t1℃时,所得溶液的溶质质量分数关系是b>a>c
D. 将混有少量b物质的a提纯,可采用降温结晶的方法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小林同学在体育课上腿部擦伤,医务室的大夫在她伤口上涂了医用过氧化氢溶液,小林看到伤口处产生了小气泡,很好奇。为什么瓶中的过氧化氢溶液涂到伤口上,分解就加快了呢?

I.小林准备用如下图所示装置测定过氧化氢分解的快慢,实验前在注射器中吸入过氧化氢溶液,量筒内装满水。实验开始时,向试管中注入过氧化氢溶液,并用排水法收集氧气。记录2分钟收集的气体体积。

(1)请写出过氧化氢分解的反应方程式:______________。
(2)若要检验生成的气体是否为氧气,可将导气管从水中取出,取带火星的木条放在导气管口处,观察到__________,说明生成的气体是氧气。
II.小林查阅了相关资料,并进行了探究实验
(查阅资料)
(1)过氧化氢是人体代谢废物之一,它能够对机体造成损害,人体存在过氧化氢酶,可以催化过氧化氢分解。
(2)温度对化学反应的快慢有影响,人体正常体温是37℃。
(提出猜想)猜想1: 过氧化氢分解加快是因为体温比瓶中的温度高。
猜想2:过氧化氢分解加快是因为伤口中有过氧化氢酶。
(进行实验)
序号 | 实验步骤 | 实验现象 | 实验结论 |
① | 分两次进行实验,均注入5 mL过氧化氢溶液 第一次在常温下进行 第二次将试管浸在37℃的温水中 | 量筒中2分钟收集到的气体体积均为5 mL | _____ |
② | 分两次进行实验 第一次将装有一小粒过氧化氢酶的试管浸在37℃的温水中,注入5 mL过氧化氢溶液 第二次__________ | 第一次,量筒中2分钟收集到的气体体积为56 mL 第二次,量筒中2分钟收集到的气体体积为5 mL | 过氧化氢分解加快是因为过氧化氢酶的作用 |
(3)实验①得出的结论是___________。
(4)实验②中第一次收集到的氧气体积为__________ mL。
(5)实验②中横线部分应进行的操作是__________。
(实验反思)
小林反思了实验过程,认为人体中过氧化氢酶是在体温条件下发挥作用的,实验得出的结论可能存在不足。因此又补充进行了几组实验,数据记录如下表所示。
加入过氧化氢酶 | 不加过氧化氢酶 | |||||
反应温度/ ℃ | 25 | 37 | 42 | 25 | 37 | 42 |
收集到气体体积/ mL | 39 | 56 | 34 | 5 | 5 | 5 |
(6)通过这些数据,你能得出的新结论是__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组利用下列装置进行气体的制取实验,请回答下列问题.
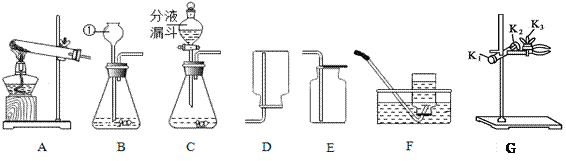
(1)写出标号①仪器的名称___________.
(2)用高锰酸钾制取和收集较纯净的氧气,选择的装置组合是___(填字母)写出反应的化学方程式______________________________,实验后发现制得的氧气不纯,可能的原因是_________________________.(答一点即可)
(3)如图G,要调节夹持试管的铁夹的松紧,应调节旋钮___(填“K1”“K2”或“K3”)。
(4)实验室制取二氧化碳的化学方程式______________________,与B相比,C作为制取二氧化碳的发生装置,优点是_______________,验证二氧化碳收集满的方法是______________________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如下表中数据为氯化钠和硝酸钾在不同温度时的溶解度,如图所示是用其中一种物质所做的实验。下列分析正确的是( )

温度(℃) | 10 | 20 | 30 | 40 | |
溶解度/g | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 |
NaCl | 35.8 | 36.0 | 36.3 | 36.6 | |
A. 实验中加入的物质R是氯化钠 B. ④中t的取值范围在30~40之间
C. ③中的溶液可能是饱和溶液 D. ④中溶液的溶质质量分数可能比②中的大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下充分发生化学反应,测得反应前后各物质的质量变化如图。下列说法中错误的是 ( )
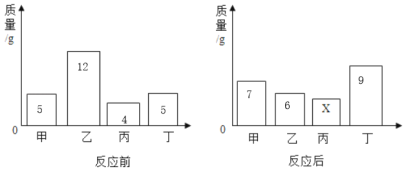
A. 丙可能为该反应的催化剂 B. 该反应中丁、乙质量变化之比为2:3
C. 反应后图中的X=4 D. 该反应为化合反应
查看答案和解析>>
科目:初中化学 来源: 题型:
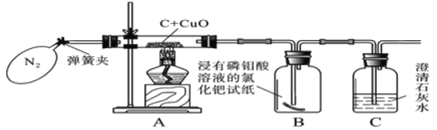
【题目】同学们在学习碳的化学性质之后得知碳燃烧时可能生成二氧化碳,也可能生成一氧化碳,某化学兴趣小组对木炭还原氧化铜可能生成的气体成分进行实验探究。
(提出问题)碳与氧化铜反应可能生成什么气体?
(提出猜想)猜想①:只生成CO2; 猜想②:____________; 猜想③:既生成CO,又生成CO2
(查阅资料)浸有磷钼酸溶液的氯化钯试纸遇CO2无变化,但遇微量的CO也会立即变成蓝色。
(实验验证)小组同学经过思考之后,设计了如图所示的实验装置:
步骤一:打开弹簧夹,先通一会儿纯净干燥的氮气;
步骤二:关闭弹簧夹,点燃酒精灯对玻璃管加热。
步骤三:实验结束后,拆洗装置和仪器。
(1)实验开始时,先将氮气通入实验装置一段时间再加热的目的是_____________;
(2)对A装置的玻璃管集中加热一段时间,玻璃管中黑色粉末逐渐变成红色,B瓶中试纸变蓝,C中澄清石灰水变浑浊。
(实验结论)
(3)通过对实验现象的分析,上述猜想________(填序号)是正确的。
(实验反思)
(4)请从环保的角度分析,实验装置中存在不完善之处是____________。
(拓展应用)实验结束后,同学们发现玻璃管内壁附着的铜用水不易清洗干净,通过查阅资料获得三种能清除铜的方案:
Ⅰ.加入浓硫酸并微热:Cu + 2H2SO4(浓)![]() CuSO4+ SO2↑+ 2H2O
CuSO4+ SO2↑+ 2H2O
Ⅱ.加入浓硝酸与铜反应:Cu + 4HNO3(浓) = Cu(NO3)2+2NO2↑+ 2H2O
Ⅲ.加入氯化铁溶液:Cu + 2FeCl3= 2FeCl2+ CuCl2
(5)为了将试管内壁上附着的铜清洗干净,上述最佳的方案是__(填序号)理由是___________(写一种合理的理由即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在学习碳酸钠的性质时,做过“向盛有少量碳酸钠溶液的试管里滴入澄清的石灰水”的实验,发现没有看见白色沉淀的现象。经分析,可能是石灰水变质了,变质的原因是(用化学方程式表示)_____________________________。用实验来证明石灰水完全变质,所用的试剂是________,产生的现象是______________________________。若不考虑用错药品,还有可能导致没有看见白色沉淀的现象的原因____________________________。(此空2分)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列化学用语中,正确的是
A. 2个镁离子:2Mg2+ B. 氧化钠:NaO
C. 2H2O的相对分子质量之和为20 D. +2价的镁元素:Mg2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com